成果情報 「全ライフコースを対象とした個体の機能低下機構の解明」研究開発領域―体内時計を自在に操作する夢に期待―
成果情報
東京大学
日本医療研究開発機構
研究成果のポイント
- 細胞ストレス応答キナーゼASKが体内時計の入力因子として機能することを発見し、ASKの活性を変化させることにより体内時計を操作できることを示した。
- 一日の代謝サイクルに応答する細胞内レドックス状態と細胞内の分子時計という二つの歯車がかみ合う連結点としてASKキナーゼが機能する可能性を示した。
- 不規則な生活や時差ボケ、あるいは老化に伴う体内時計の乱れは、癌や高血圧などのリスクを増大させるが、ASKはこれらを根本から治す創薬ターゲットとなり得る。
概要
睡眠やホルモン分泌など様々な生理現象には約24時間周期のリズム性が見られ、このリズムは全身の細胞一つ一つに備わっている体内時計が生み出しています。東京大学大学院理学系研究科の深田吉孝教授、吉種光助教、今村聖路大学院生らの研究グループは、マウスやヒト由来の培養細胞に細胞ストレスを与えることにより、体内時計の周期や位相が操作できることを見出しました。そこで、多様な細胞ストレスに応答して活性化するリン酸化酵素ASKを発見した同薬学系研究科の一條秀憲教授と共同研究を行い、ASKキナーゼが体内時計の時刻合わせの役割を担うことを見出しました。ASKキナーゼの活性は細胞内の酸化・還元状態(レドックス)の変化に敏感に応答するという一條教授グループの知見と、細胞内レドックス状態が代謝に伴って約24時間周期で変動するという先行知見などを併せると、ASKキナーゼは細胞内のレドックスリズムと体内時計を連結する鍵分子となり得ます。
近年、不規則な生活や交代勤務により、不眠や代謝異常、高血圧など、様々な疾病リスクが増大しています。体内時計を制御する仕組みの理解は、これら疾病発症を根本から治療可能な薬の開発につながる重要な基礎研究です。
本研究の成果
生物は約24時間周期でリズムを刻む概日時計(注1)機構を備えており、睡眠・覚醒や血圧などの様々な生理現象のリズムを生み出しています。この時計機構は全身の細胞一つ一つに備わっていて、個々の細胞、組織、個体レベルでの機能を積極的に変化させることにより、細胞外環境の周期的な変化に適応しています。一方で、急激な細胞外環境の変化が発生した際には、細胞ストレス応答(注2)シグナルが活性化されて生体の恒常性が維持されますが、概日時計が細胞ストレスに応答するか否かは不明でした。さらにその際、時計のストレス応答を担う鍵分子は未同定でした。
東京大学大学院理学系研究科の深田吉孝教授、吉種光助教、今村聖路らの研究グループは、マウスやヒト由来の培養細胞に対して、培地の浸透圧を変化させるというストレス刺激を与えることにより、細胞時計の周期と位相の両方を操作できることを見出しました(図1)。細胞ストレスが時計を制御する仕組みを探るために、東京大学大学院薬学系研究科の一條秀憲教授らとの共同研究として、細胞ストレスに応答してその活性が柔軟に変化するリン酸化酵素ASK(注3)に着目しました。具体的には、ASK欠損マウスより培養細胞を採取し、同様のストレス刺激を与えたところ、刺激に依存した時計への効果が完全に消失しました。つまり、細胞ストレスによる時計の制御には、ASKキナーゼが必須であることが明らかになりました。さらに、細胞内の酸化・還元状態(レドックス)の変化によっても、ASK依存的に体内時計が制御されていることを見出しました。細胞内のレドックス環境は代謝に伴って一日周期で変化することが報告されていることから、ASKキナーゼはこのようなレドックスリズムと体内時計を結びつける重要な役割を担う可能性も考えられます。ASK依存的な時計入力の重要性は、細胞レベルだけではなく、マウス個体の行動レベルにおいても観察されました。光条件を制御できる飼育部屋において回転輪を設置してマウスを飼育することにより、マウスの自発行動リズムを測定しました。マウスの行動リズムは、飼育部屋の光照度を高くするとその周期が長くなることが知られていますが、測定の結果、Ask欠損マウスでは、この光による長周期化が顕著に減弱することが判明しました(図2左)。さらに、夜間の光照射は体内時計の時刻合わせを導きますが、この光による時計位相の変化もASK欠損マウスでは減弱していました(図2右)。
一日の中の様々な時刻にマウスの肝臓を摘出し、Ask遺伝子の発現プロファイルを解析したところ、興味深いことに、Ask遺伝子は概日時計の制御を受けて発現量がリズミックに制御されていました(図3左)。このAskの発現リズムは、時計遺伝子Bmal1(注4)を欠損したマウスにおいて消失していました(図3左)。すなわち、ASKは細胞ストレスに応答して概日時計を制御する一方で、概日時計の支配を受けていると考えられます(図3右)。
ASKの活性を変化させることにより概日時計をコントロールできることがわかりましたが、その分子的な仕組みに迫るため、質量分析装置(注5)を用いたリン酸化プロテオーム解析を行いました。その結果、細胞ストレスに応答してリン酸化状態が変化する分子の中で、Ask遺伝子の欠損によりその応答が消失する65種類のリン酸化ペプチドを同定しました。このリン酸化ペプチドの中には、時計タンパク質CLOCK(注6)由来の配列が含まれており、細胞ストレスに応答してASK依存的にCLOCKのC末端領域にあるThr843またはSer845がリン酸化され、その結果として体内時計の周期や位相がコントロールされている可能性が示唆されました。
本研究においては、概日時計の時刻合わせに不可欠な鍵因子としてASKキナーゼを同定しました(図4)。24時間化やグローバル化が進んだ現代において、体内時計の乱れにより、不眠や代謝異常、高血圧などの様々な疾病リスクが増大しています。中でも「概日リズム障害を伴う交代制勤務」が国連WHOから発ガンのリスク因子に挙げられたことは特筆すべきことです。さらに、老化に伴う体内時計の乱れは、様々な臓器の機能低下を導くことから、本研究成果を応用して体内時計を自在に操作することができるようになれば、時差ボケや交代勤務、老化に伴う疾病発症を根本から解決する新薬の開発につながると期待できます。
本成果は、本研究成果は、米国科学アカデミー紀要(PNAS)に掲載されるのに先立ち、オンライン版(日本時間3月20日)に掲載されました。なお本研究は、科学研究費補助金 「特別推進研究」および「基盤研究S」に加えて、国立研究開発法人日本医療研究開発機構(AMED)革新的先端研究開発支援事業(PRIME)「全ライフコースを対象とした個体の機能低下機構の解明」などの支援を得て行われました。
論文
- 雑誌名:
- Proceeding of the National Academy of Sciences, USA(オンライン版:日本時間3月20日)
- 論文タイトル:
- ASK family kinases mediate cellular stress and redox signaling to circadian clock
- 著者:
- Kiyomichi Imamura, Hikari Yoshitane, Kazuki Hattori, Mitsuo Yamaguchi, Kento Yoshida, Takenori Okubo, Isao Naguro, Hidenori Ichijo, Yoshitaka Fukada
用語解説
- (注1)概日時計:
- 体内時計の一種であり、地球上のほぼすべての生物が持つ。睡眠・覚醒やホルモン分泌のリズムなど、約24時間周期の生物学的なリズムを生み出している。光などの時刻情報がない環境においても約24時間周期のリズム性が保たれる生理現象は概日時計によって支配されており、地球環境の24時間周期のサイクルに同調する。
- (注2)細胞ストレス応答:
- 紫外線、化学物質、温度変化、pH変化、浸透圧変化などさまざまな環境変化(細胞ストレス)に適応し、生存を可能にするために細胞レベルで起こる機構。
- (注3)ASK:
- Apoptosis Signal-regulating Kinaseの略。細胞ストレス応答に関わるタンパク質リン酸化酵素であり、ヒトを含めた脊椎動物ではASK1 (MAP3K5), ASK2 (MAP3K6), ASK3 (MAP3K15) の3遺伝子が同定されている。細胞ストレスに応答して酵素活性が柔軟に変化する。
- (注4)Bmal1:
- 哺乳類において概日時計を発振させるために最も重要な遺伝子の一つ。Bmal1遺伝子を欠損した変異マウスでは遺伝子の発現リズムや睡眠・覚醒リズムが消失する。
- (注5)質量分析装置:
- 本研究では、LC-MS/MSプロテオーム解析と呼ばれる方法を用いた。タンパク質を断片化してペプチドの状態にし、逆相HPLCで分離・濃縮しながらハイブリッド型質量分析装置でその質量を測定した。
- (注6)CLOCK:
- 哺乳類において概日時計を発振させるために最も重要なタンパク質の一つ。BMAL1とパートナーを形成することにより遺伝子の発現を活性化させる役割をもっており、数多くの遺伝子(全遺伝子の50-80%程度とも言われる)の発現をリズミックに調節している。
添付資料
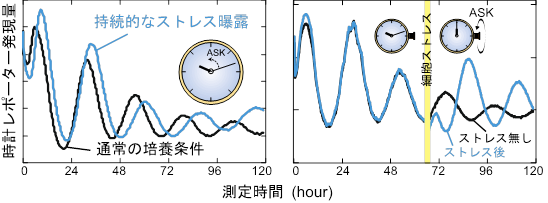
図1:細胞ストレスによるASKを介した概日時計の制御
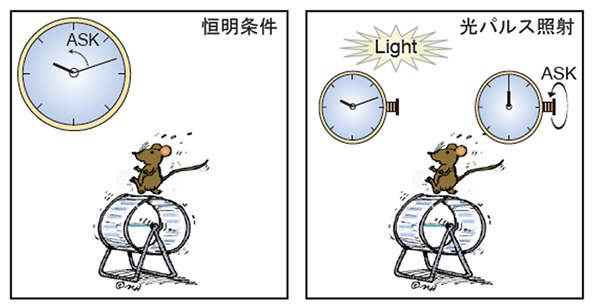
図2:光によるASKを介した行動リズムの制御
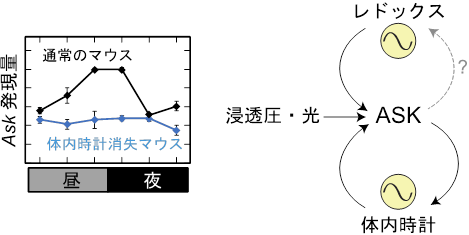
図3:体内時計による一日を通したAsk発現量の制御

図4:Mouse ASK asks the time(本研究成果の概要イメージ図)
お問い合わせ先
研究に関すること
東京大学 大学院理学系研究科 生物科学専攻
教授 深田 孝(ふかだ よしたか)
TEL:03-5841-4381 E-mail:sfukada”AT”mail.ecc.u-tokyo.ac.jp
東京大学 大学院理学系研究科 生物科学専攻
助教 吉種 光(よしたね ひかり)
TEL:03-5841-4382 E-mail:stane”AT”mail.ecc.u-tokyo.ac.jp
報道に関すること
東京大学 大学院理学系研究科・理学部
特任専門職員 武田 加奈子、学術支援職員 谷合 純子、教授・広報室長 大越 慎一
TEL:03-5841-0654 E-mail:kouhou”AT”adm.s.u-tokyo.ac.jp
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課
TEL:03-6870-2224 E-mail:kenkyuk-ask”AT”amed.go.jp
E-mailは上記アドレス”AT”の部分を@に変えてください。
関連リンク
掲載日 平成30年5月2日
最終更新日 平成30年5月2日


