成果情報 ALS発症機構に基づいた治療薬の基盤を開発
成果情報
国立大学法人東京大学大学院薬学系研究科
国立研究開発法人日本医療研究開発機構
発表者
圓谷 奈保美(研究当時:東京大学大学院薬学系研究科 薬科学専攻 博士課程3年生)
本間 謙吾(研究当時:東京大学大学院薬学系研究科 薬科学専攻 特任助教)
藤澤 貴央(東京大学大学院薬学系研究科 薬科学専攻 助教)
一條 秀憲(東京大学大学院薬学系研究科 薬科学専攻 教授)
発表のポイント
- SOD1とDerlin-1という2つのタンパク質の結合を阻害することで、筋萎縮性側索硬化症(Amyotrophic Lateral Sclerosis;ALS)の病態が改善することを明らかにしました。
- ALSが発症する分子メカニズムに基づいた治療薬の候補として、SOD1とDerlin-1のタンパク質間相互作用を阻害する化合物を見出しました。
- 本研究成果は、ALS発症機構に基づいた治療薬の開発に繋がることが期待されます。
発表概要
筋萎縮性側索硬化症(ALS)は運動神経細胞が選択的に障害を受ける神経変性疾患ですが、発症メカニズムに基づいた効果的な治療薬・治療方法は明らかになっていません。ALSを引き起こす原因の一つとして、SOD1遺伝子(注1)変異が知られています。東京大学大学院薬学系研究科の一條秀憲教授らの研究グループは、これまでALSで発見された変異型SOD1が本来とは異なる構造をとり、小胞体に存在するDerlin-1(注2)というタンパク質と結合することで、運動神経細胞死を引き起こすことを明らかにしてきました。しかし、この2つのタンパク質の結合を阻害することが、本当にALS病態の改善に繋がるかについては不明でした。
今回同研究グループは、東京大学創薬機構との共同研究により、約16万種類の化合物の中からSOD1とDerlin-1の結合を阻害する化合物を見出しました。さらに、本化合物を改良した化合物がALS病態改善効果を示すことを明らかにしました。本研究成果は、SOD1とDerlin-1のタンパク質間相互作用の阻害がALS治療標的になること、分子メカニズムに基づいたALS治療薬の開発基盤候補として、SOD1とDerlin-1のタンパク質間相互作用を阻害する化合物の創出に成功したことを示しており、今後発症機構に基づいた新規ALS治療薬の開発に繋がることが期待されます。
本成果は、2018年7月10日(英国時間)に、英国の科学雑誌「Nature Communications」のオンライン版に公開されました。なお本研究は、文部科学省脳科学研究戦略推進プログラムの一環として、また科学研究費補助金ならびに医薬基盤研究所先駆的医薬品・医療機器研究発掘支援事業や日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業などの助成を受けて行われました。
発表内容
研究の背景
筋萎縮性側索硬化症(Amyotrophic Lateral Sclerosis;ALS)は、50代~70代にかけた人生の中盤から後半において発症する割合が高い、運動神経が特異的に障害される神経変性疾患です。ALSが発症する原因の1つとしてCu/Zn superoxide dismutase (SOD1) の遺伝子変異が知られています。しかしながら、SOD1遺伝子に変異が入ることで、どのようなメカニズムで運動神経細胞死が惹起されるのか、その詳細はわかっていません。
東京大学大学院薬学系研究科の一條秀憲教授らは、これまでの研究によりALS患者で発見された変異型SOD1が、小胞体に存在するDerlin-1というタンパク質と結合することを明らかにしました。細胞内小器官である小胞体の重要な機能の一つとして、膜タンパク質や分泌タンパク質の品質管理が挙げられます。小胞体内で正しい立体構造を取れなかったタンパク質は分解されて取り除かれることが知られており、Derlin-1はこの過程に重要な役割を担っています。本研究により、変異型SOD1がDerlin-1と結合するとDerlin-1が正常に機能できなくなり、異常な構造のタンパク質が小胞体内に蓄積した結果、運動神経細胞死が引き起こされることがわかりました。
しかしながら、実際にこの結合がALSの治療標的となるのかはこれまでの研究ではわかっていませんでした。また、一般的にタンパク質同士の結合を化合物によって選択的に阻害することは難しいと考えられており、SOD1とDerlin-1の結合を阻害する化合物も見つかっていませんでした。
研究の詳細
今回、同研究科の圓谷奈保美大学院学生(研究当時)、本間謙吾特任助教(研究当時)、一條秀憲教授らの研究グループは、変異型SOD1とDerlin-1の結合を迅速かつ安定的に評価できる実験系を樹立しました。本実験系を利用し、東京大学創薬機構が所有する約16万化合物の中から、変異型SOD1とDerlin-1の結合を阻害する化合物の探索を行い、この結合を顕著に阻害する化合物を見いだすことに成功しました。結合阻害様式に関する解析を行った結果、この化合物は変異型SOD1のDerlin-1との結合部位と相互作用することで、両者の結合を阻害していることがわかりました。また、この化合物を改良することで、細胞内で活性を発揮できる誘導体の作出に成功しました。
そこで、改良した化合物を用いて、SOD1とDerlin-1の結合阻害がALS病態に対して改善効果を発揮するか検証したところ、本化合物はSOD1遺伝子に変異を持つALS患者由来iPS細胞から作製したALS運動神経細胞の細胞死を抑制することができました。さらに、変異型SOD1を発現するALSモデルマウスに本化合物を投与したところ、投与していない群と比較して病気を発症する時期が遅延し、生存している期間が長くなりました。
この結果は、変異型SOD1とDerlin-1の結合を阻害することがALS病態の改善に繋がること示唆しています。また、本化合物が100種類を超える変異型SOD1とDerlin-1の結合を全て阻害することができたことから、本化合物は非常に多くの変異型SOD1の毒性を抑えることができると考えられます。
以上の結果は、SOD1とDerlin-1という2つのタンパク質間の結合阻害がSOD1遺伝子変異によるALS病態の治療標的になること示唆しており、さらに、分子メカニズムに基づいたALS治療薬の開発基盤となりうる化合物として、SOD1とDerlin-1のタンパク質間相互作用を阻害する化合物の創出に成功したことを示しています。
社会的意義・今後の期待
本研究成果は、未だ発症機構が明確になっていないALSの病態発症機構の全容解明と治療薬の開発に繋がる結果であると考えています。本研究により、SOD1遺伝子変異によるALS発症メカニズムにおいて、変異型SOD1とDerlin-1の結合が運動神経細胞死に重要な役割を担っていることが示されたことから、今後の新たな治療薬の創出の契機になるとことが期待されます。
さらに、本研究の中で創出されたSOD1とDerlin-1のタンパク質間相互作用を阻害する化合物がALS病態を改善する効果を示したことから、今後本化合物をさらに改良していくことにより、発症機構に基づいたALS治療薬の開発に繋がることを期待しています。
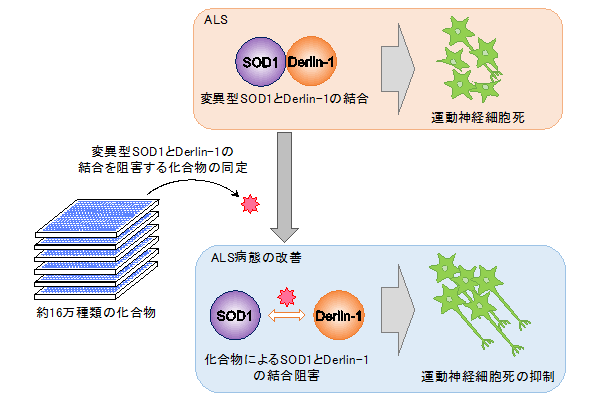
図 SOD1とDerlin-1結合阻害剤によるALS病態改善効果
発表雑誌
- 雑誌名:
- Nature Communications
- 論文タイトル:
- A small-molecule inhibitor of SOD1-Derlin-1 interaction ameliorates pathology in an ALS mouse model
- 著者:
- Naomi Tsuburaya, Kengo Homma, Tsunehiko Higuchi, Andrii Balia, Hiroyuki Yamakoshi, Norio Shibata, Seiichi Nakamura, Hidehiko Nakagawa, Shin-ichi Ikeda, Naoki Umezawa, Nobuki Kato, Satoshi Yokoshima, Masatoshi Shibuya, Manabu Shimonishi, Hirotatsu Kojima, Takayoshi Okabe, Tetsuo Nagano, Isao Naguro, Keiko Imamura, Haruhisa Inoue, Takao Fujisawa, and Hidenori Ichijo
- DOI番号:
- 10.1038/s41467-018-05127-2
- アブストラクトURL:
- http://www.nature.com/articles/s41467-018-05127-2
用語解説
- (注1)SOD1(Cu/Zn superoxide dismutase):
- スーパーオキシドを酸素と過酸化水素へ不均化する抗酸化酵素です。ALS患者で高頻度に見られる原因遺伝子であり、160種類以上の遺伝子変異が報告されています。
- (注2)Derlin-1:
- 小胞体内の異常な構造のタンパク質を分解する機構に重要な役割を担う小胞体膜タンパク質です。
AMED事業
- 事業名:
- 創薬等ライフサイエンス研究支援基盤事業
- 課題名:
- ①大型創薬研究基盤を活用した創薬オープンイノベーションの推進(平成24年度~平成28年度)
②実践創薬ナレッジとイノベーションで拓くリード創出(実践創薬ナレッジで拓くワンストップアカデミア創薬リード創出)(平成29年度~平成33年度(予定)) - 代表者:
- ①東京大学 教授 一條 秀憲
②東京大学 特任教授 宮地 弘幸
本事業は、本事業に参加する研究者が自身の技術を高度化しつつ、外部研究者の研究を支援するものです。
本研究成果は、一條秀憲教授らの研究グループが上記①の課題で整備する化合物ライブラリーを用いてスクリーニングの結果得られたヒット化合物の構造展開を行い、②の課題から化合物の物性評価と吸収・分布・代謝・排泄に関係するパラメーター評価について支援を受けたものです。
問い合わせ先
研究内容
東京大学大学院薬学系研究科 細胞情報学教室
教授 一條 秀憲(いちじょう ひでのり)
〒113-0033 東京都文京区本郷7-3-1
Tel:03-5841-4858
E-mail:ichijo"AT"mol.f.u-tokyo.ac.jp
※一條不在時、藤澤 貴央(連絡先電話番号:同上)
AMED事業
日本医療研究開発機構(AMED)創薬戦略部 医薬品研究課
TEL:03-6870-2219
E-mail:20-DDLSG-16"AT"amed.go.jp
※E-mailは上記アドレス"AT"の部分を@に変えてください。
関連リンク
掲載日 平成30年7月20日
最終更新日 平成30年7月20日


