成果情報 真核生物での遺伝子読み取りの仕組みを解明
成果情報
国立大学法人東京大学
国立研究開発法人理化学研究所
国立研究開発法人日本医療研究開発機構
成果のポイント
- 遺伝子の読み取り装置であるRNAポリメラーゼが、ヒストンタンパク質によって折りたたまれた染色体構造中のDNAを読み取る姿(構造)を、クライオ電子顕微鏡を用いて解明した。
- 生物学上の謎であった、染色体中に折りたたまれたDNAから遺伝情報を読み取る仕組みを初めて解明した。
- 染色体でのDNAの折りたたみの不具合は遺伝情報の読み取りの異常を招き、がんや精神・神経疾患などの原因となることがあるため、本発見はこれらの疾病の治療法の開発につながることが期待される。
成果概要
ヒトを始めとする真核生物では、遺伝情報を持つDNAはヒストンタンパク質と結合してヌクレオソームと呼ばれる構造体を形成し、ヌクレオソームが数珠状に連なった状態(折りたたまれた状態)で染色体に収納されています。DNAの遺伝情報は、RNAポリメラーゼによって読み取られることで機能します。しかし、ヌクレオソーム中でヒストンに巻きついたDNAがRNAポリメラーゼによって読み取られるメカニズムは、長い間の生命科学上の謎でした。
東京大学定量生命科学研究所の胡桃坂仁志教授、鯨井智也助教、理化学研究所生命機能科学センターの関根俊一チームリーダー、江原晴彦研究員、白水美香子チームリーダーらは共同で、転写装置であるRNAポリメラーゼⅡがヌクレオソームのDNAを転写している最中の複合体を試験管内において再構成し、転写反応の各ステップの立体構造を、クライオ電子顕微鏡を用いて解明しました。
今回明らかになった一連の立体構造から、RNAポリメラーゼⅡがヒストンに巻きついたDNAを段階的に剥がしながら遺伝子の読み取りを行う様子が明らかになりました。
染色体におけるDNAの折りたたみの破綻は、RNAポリメラーゼⅡの読み取り異常を誘発するため、がんや精神・神経疾患、メタボリックシンドロームなどの生活習慣病の発症と密接に関連しています。今回の発見は、これらの疾病の原因解明や治療法確立のための重要な情報を提供します。
なお、本研究の一部はAMED創薬等ライフサイエンス研究支援基盤事業の支援を受けて行われたものです。
成果内容
研究の背景・先行研究における問題点
ヒトをはじめとする真核生物では、遺伝情報の本体であるDNAは、ヌクレオソーム(注1)が数珠状に連なるクロマチンと呼ばれる構造をとり、染色体を形成しています。ヌクレオソームは、ヒストンタンパク質にDNAが巻きついた円盤状の構造体です。生命の維持に必須である遺伝情報の読み取りは、クロマチンの上でなされています。その実態は、RNAポリメラーゼⅡ(注2)がDNAを読み取り、メッセンジャーRNAを合成する転写反応です(図1)。しかし、RNAポリメラーゼⅡがヒストンに巻きついたDNAを転写する機構に関しては、これまでに多くの研究がなされてきましたが、ほとんどわかっていませんでした。
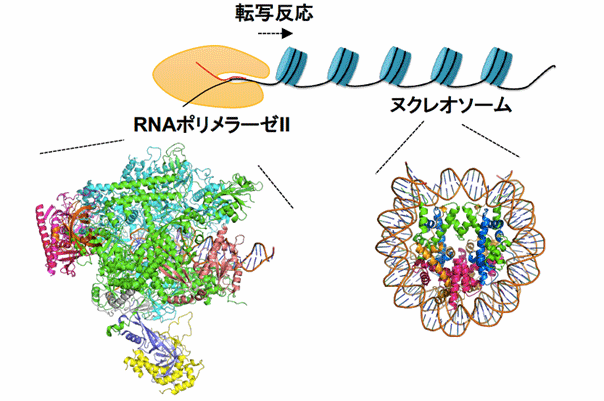
図1 真核生物でのヌクレオソームでのRNAポリメラーゼⅡによる転写反応
研究内容
東京大学定量生命科学研究所・胡桃坂教授、理化学研究所生命機能科学研究センター・関根チームリーダーらは、試験管内においてヌクレオソームを再構成し、ヌクレオソームを形成したDNAをRNAポリメラーゼⅡによって転写させる実験を行いました。その結果、RNAポリメラーゼⅡはヌクレオソーム上の特定の4箇所で一時的に停止しながら転写を遂行することがわかりました。そこで、それらの停止位置でのRNAポリメラーゼⅡとヌクレオソームとの複合体を調製し、理化学研究所(横浜地区)のクライオ電子顕微鏡を用いた単粒子解析によってそれらの立体構造を解明することに成功しました。構造解析の結果、RNAポリメラーゼⅡは、ヌクレオソーム中のDNAを0、20、50、60塩基対と段階的に剥がすことで転写を遂行していることが解明されました(図2)。
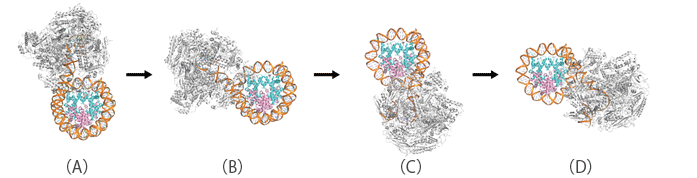
図2 本研究から明らかになった段階的なヌクレオソームDNAの読み取りの様子
これまでのX線結晶解析を中心とした構造解析研究では、サンプルの単離精製と結晶化が必須でした。しかし、転写を行っている最中の各ステップにおけるRNAポリメラーゼⅡとヌクレオソームとの複合体の単離精製はとても困難であり、成功していませんでした。そのため、RNAポリメラーゼⅡがどのようにヌクレオソーム中のDNAを転写しているのかは不明のままでした。今回は、最新のクライオ電子顕微鏡法(注3)の技術によって、それぞれのステップごとにRNAポリメラーゼⅡとヌクレオソームとの複合体を単離精製することなく、すべてのステップでの複合体が混在した状態でデータを取得し、コンピューター上で個別に解析することで構造決定を成し遂げました。
社会的意義・今後の予定
染色体を構成するDNAのヌクレオソーム構造は可逆的に変化し、遺伝子のオンとオフを制御することが知られています。このようなDNA配列に依存しない、ヌクレオソーム中のDNAの折りたたみによる遺伝子のオンとオフの制御はエピジェネティクスと呼ばれ、近年注目を集めています。エピジェネティクスは、受精卵から多種多様な組織や臓器が作られる発生過程において、細胞の分化や増殖に重要な役割を果たしています。DNAの折りたたみの破綻はエピジェネティクスの異常を招き、本来オフの遺伝子をRNAポリメラーゼⅡが読み取ってしまうなど細胞の正常な機能が失われ、がん、精神・神経疾患、メタボリックシンドロームなどの生活習慣病が引き起こされる原因になると考えられています。
遺伝子オンの状態では、RNAポリメラーゼⅡが読み取り可能な状態でDNAが折りたたまれていますが、どのようにヌクレオソーム中でDNAが読み取られているのかは大きな謎でした。今回の発見は、このような生命科学上の謎を解明したことに加え、これらの疾病の原因解明や治療法確立のための重要な情報を提供します。
本研究では、最も基本的な型のヌクレオソーム構造をRNAポリメラーゼⅡが読み取るプロセスを解明しました。しかし、ヒトを含む真核生物の染色体では、多様なヌクレオソーム構造が形成されており、それらがどのようにRNAポリメラーゼⅡによって読み取られているのか、そのメカニズムを明らかにすることが今後の課題です。また、RNAポリメラーゼⅡと共同して働く転写活性化因子群のヌクレオソームDNAの読み取りにおける役割の解明など、今後、爆発的な展開が期待できます。
発表雑誌
- 雑誌名:
- 「Science」(オンライン版:平成30年10月4日)
- 論文タイトル:
- Structural basis of the nucleosome transition during RNA polymeraseⅡpassage
- 著者:
- Tomoya Kujirai†, Haruhiko Ehara†, Yuka Fujino, Mikako Shirouzu, Shun-ichi Sekine*, Hitoshi Kurumizaka*
(※第一著者に†、責任著者に*)
用語解説
- 注1 ヌクレオソーム:
- 真核生物のゲノムDNAを折りたたむ基盤の構造。ヒストンタンパク質で作られるコアに、DNAが左巻きに1.7回転巻きついている。
- 注2 RNAポリメラーゼⅡ:
- 真核生物の遺伝子を読み取るタンパク質複合体。転写によって、タンパク質合成の鋳型となるメッセンジャーRNAを作る。
- 注3 クライオ電子顕微鏡法:
- サンプルを氷に埋め込んだ状態で、電子顕微鏡によって生体高分子の立体構造を解析する手法。クライオ電子顕微鏡法の開発は2017年にノーベル化学賞を受賞。
AMED事業
- 事業名:
- 創薬等ライフサイエンス研究支援基盤事業(平成29年度~平成33年度(予定))
- 課題名:
- ①エピジェネティクス研究と創薬のための再構成クロマチンの生産と性状解析
(研究開発代表者:東京大学 定量生命科学研究所 クロマチン構造機能研究分野 教授 胡桃坂仁志) - ②統合的構造解析に向けた高難度複合体の生産支援と高度化
(研究開発代表者:理化学研究所 生命機能科学研究センター チームリーダー 白水美香子)
①の課題で東京大学がヌクレオソームの調製、クライオ電子顕微鏡解析用の転写伸長複合体の調製を行い、②の課題で理化学研究所がRNAポリメラーゼⅡ及び転写因子の調製、クライオ電子顕微鏡測定及び構造解析を行いました。
問い合わせ先
研究内容に関すること
胡桃坂仁志(東京大学 定量生命科学研究所 クロマチン構造機能研究分野 教授)
Tel:03-5841-7826 E-mail:kurumizaka"AT"iam.u-tokyo.ac.jp
関根俊一(理化学研究所 生命機能科学研究センター チームリーダー)
Tel:045-503-9204 E-mail:shunichi.sekine"AT"riken.jp
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
創薬戦略部 医薬品研究課
Tel:03-6870-2219 E-mail:20-DDLSG-16"AT"amed.go.jp
※E-mailは上記アドレス”AT”の部分を@に変えてください。
関連リンク
掲載日 平成30年10月15日
最終更新日 平成30年10月15日


