薬剤耐性の原因「薬剤汲み出しタンパク質」の排出メカニズムを解明―多剤排出トランスポーターMdfAの分子機構―
成果情報
大学共同利用機関法人 高エネルギー加速器研究機構
国立大学法人 京都大学
国立大学法人 東京大学
国立大学法人 岡山大学
国立研究開発法人 日本医療研究開発機構
本研究成果のポイント
- 細菌に存在する抗菌剤等の薬剤を排出する多剤排出トランスポーター(注1)の一つ、MdfAの構造解析に成功し、初めてMdfAの外開き構造を明らかにした。
- 膜内に存在する特定の酸性残基のプロトン化(注2)が、外開き構造から内向き構造への引き金となることを明らかにした。
- 精製MdfAタンパク質を脂質膜に組み込んだ形で初めて薬剤輸送活性を測定し、薬剤輸送に重要なアミノ酸残基を明らかにした。
概要
細菌が薬剤耐性を引き起こす主な原因は、細菌膜上に存在する多剤排出トランスポーターと呼ばれるタンパク質が、投与された薬剤をポンプのように細菌外に汲み出してしまい、薬剤の効果を無効化することにあります。MFS(Major facilitator superfamily)型と呼ばれる多剤排出トランスポーターは細菌上に多数存在しますが、どのように薬剤分子を認識して細菌外に排出するのか、その分子機構については明らかになっていません。
そこで高エネルギー加速器研究機構(KEK)物質構造科学研究所、マルティン=ルター大学 Institut für Biochemie und Biotechnologie, HALOmem(ドイツ)、京都大学 医学研究科、東京大学 農学生命科学研究科、岡山大学 医歯薬学総合研究科ならびに自然生命科学研究支援センターからなる共同研究グループは、MFS型多剤排出トランスポーターの一つであるMdfAをモデルとした薬剤排出メカニズムの研究を行い、結晶構造解析・輸送活性実験・分子動力学シミュレーションにより、上記の薬剤分子輸送のメカニズムの詳細を明らかにしました。
本知見は、薬剤分子排出への理解を深め、将来的には、多剤排出トランスポーターの働きを抑えることで、薬剤耐性菌に対抗する治療薬の開発に貢献できると考えられます。
背景
細菌が引き起こす感染症の治療には、ペニシリンの発見以来、抗菌剤の投与が第一の選択肢となってきました。しかし近年の薬剤耐性菌の出現はこれらの化学療法に深刻な問題を引き起こしています。日本でも院内感染により病院内で複数の患者が亡くなる事例が近年たびたび報告され、医療現場では深刻な問題になっています。院内感染の多くは抗生物質(抗菌剤)が効かない薬剤耐性を持つ細菌によるものであり、世界保健機関(WHO)や各国政府機関は、今後有効な対策を講じられなければ、2050年にはこのような薬剤耐性菌により全世界で年間一千万人が死亡する(がんによる死亡を上回る)と推定し警告を発しており、薬剤耐性のメカニズムの解明が待たれています。
薬剤耐性を引き起こす多剤排出トランスポーターにはいくつかの異なる型が存在し、そのうちMFS型多剤排出トランスポーターは多くの細菌において多剤排出に重要な役割を担います。これらのトランスポーターは一般的に、輸送する分子に対する入り口を細胞質に対して内向きから外開きの向きに、繰り返し大きく構造を変化させ、薬剤分子を細菌内から細菌外に輸送すると考えられています(図1)。しかし、どのように薬剤分子を認識して細菌外に排出するのか、またその2つの構造がどんな構造を経由して切り替えられるのかなどの具体的なメカニズムは分かっていませんでした。
代表的なMFS型多剤排出トランスポーターであるMdfAの構造解析への取り組みは同時期に世界中で盛んに進められており、2015年、本研究グループに先んじて、中国科学院の研究グループによりMdfAの変異体の構造の一つが判明しました。この構造は薬剤分子の入り口が細胞質側を向いた“内向き構造”でした。
研究内容と成果
本研究ではKEKとマルティン=ルター大学の研究グループが中心になり、生化学とX線結晶構造解析(注3)の手法を用いてMdfAの薬剤排出メカニズムの研究を行いました。
MdfA単独での結晶構造解析が困難であったため、京都大学の研究グループと共同でMdfAの立体構造を特異的に認識し、かつ構造を安定化させる抗体Fabフラグメント(注4)との共結晶化を試みました。MdfA-Fab複合体のX線結晶構造解析を行ったところ、基質の入り口が細胞質の外側のペリプラズム領域(注5)を向いた“外開き構造”であることが判明しました。本グループが外開き構造を得たことで、MdfAはこれまでにその存在が予想されていた、内向き構造と外開き構造の両方の立体構造が判明した初めての多剤排出トランスポーターとなりました(図1)。中国の研究グループの内向き構造と比較すると、外開き構造ではアンチポーターに特有なアミノ酸が存在する5番目のヘリックス(注6)が大きく捻じれた構造をとっており、この捻じれが解消されることで、構造が外開きから内向き構造に変化していることが分かりました(図2)。
そこで東京大学の研究グループと共同で、何が引き金となり構造変化が引き起こされるかを分子動力学法シミュレーションにて検証しました。シミュレーションの結果、MdfAを構成するアミノ酸のうち、34番目のアスパラギン酸がプロトン化することによりペリプラズム側の領域が閉じ、外開き構造からペリプラズム側も細胞側も閉じた中間構造に遷移することが分かりました。
また、薬剤輸送にどのような影響を及ぼすかを検証するため、構造変化に重要な役割を担うと考えられるアミノ酸(図2)を置換したMdfA変異体を作成しました。それらの変異体では著しく薬剤輸送活性が低下することから、構造情報から想定された構造変化に関する仮説を支持する結果が得られました。これまでMdfAの薬剤輸送活性は細胞レベルでの薬剤耐性の間接的な測定で見積もられてきましたが、本研究では岡山大学の研究グループと共同で、精製したMdfAタンパク質を脂質でできたリポソーム(注7)に組み込み、薬剤分子クロラムフェニコール(注8)の輸送活性を直接測定できる実験系を初めて確立しました。
これまでMFS型多剤排出トランスポーターについての構造情報はほとんど得られておらず、構造のスイッチング機構に関する知見はほとんどありませんでしたが、本研究では生化学実験・結晶構造解析・輸送活性実験・分子動力学シミュレーションなど多数の手法を組み合わせることで、薬剤分子輸送の分子メカニズムの一端を明らかにすることができました。
論文名
- 雑誌名:
- 「Nature Communications」(イギリス標準時間平成30年10月1日オンライン版掲載)
- 論文タイトル:
- Outward open conformation of a Major Facilitator Superfamily multidrug/H+ antiporter provides insights into switching mechanism
- 著者:
- Kumar Nagarathinam, Yoshiko Nakada-Nakura, Christoph Parthier, Tohru Terada, Narinobu Juge, Frank Jaenecke, Kehong Liu, Yunhon Hotta, Takaaki Miyaji, Hiroshi Omote, So Iwata, Norimichi Nomura, Milton T. Stubbs and Mikio Tanabe
- DOI 番号:
- 10.1038/s41467-018-06306-x.
- アブストラクト URL:
- https://www.nature.com/articles/s41467-018-06306-x
今後への期待
細菌にはMdfAと類似したMFS型多剤排出トランスポーターが多数存在します。多剤耐性がもたらす問題を克服するためには、それらが引き起こす薬剤排出への理解を深めることが重要です。ただし多剤認識の機構に関しては、まだまだ解明できていないことも多く、引き続き研究を推進して行く必要があります。多剤排出トランスポーターの働きを抑えることは、将来的に薬剤耐性菌に対抗する治療薬の開発に貢献できると考えています。
共同研究グループ
- 生化学実験、結晶構造解析
- 高エネルギー加速器研究機構 物質構造科学研究所 構造生物学研究センター
- 特任准教授 田辺 幹雄
- マルティンルター大学 ハレ=ウィッテンベルグ(ドイツ)Institut für Biochemie und Biotechnologie, HALOmem
- 大学院博士課程学生 Kumar Nagarathinam
- 研究員 Christoph Parthier
- 研究員 Frank Jaenecke
- 教授 Milton T. Stubbs
- MdfAを特異的に認識する抗体の作成
- 京都大学 大学院医学研究科
- 研究員 名倉 淑子
- 技術員 劉 紅
- 技術員 堀田 韻虹
- 助教 野村 紀通
- 教授 岩田 想
- 分子動力学法シミュレーション
- 東京大学 大学院農学生命科学研究科
- 准教授 寺田 透
- 薬剤輸送活性
- 岡山大学 自然生命科学研究支援センター ゲノム・プロテオーム解析部門
- 助教 樹下 成信
- 准教授 宮地 孝明
- 岡山大学 大学院医歯薬学総合研究科
- 准教授 表 弘志
本研究の一部は、ドイツ連邦教育研究省(BMBF)、欧州地域開発基金(ERDF)、日本医療研究開発機構(AMED)創薬等先端技術支援基盤プラットフォーム事業(PDIS)ならびに創薬等ライフサイエンス研究支援基盤事業(BINDS)、JST戦略的創造研究推進事業ERATO「岩田ヒト膜受容体プロジェクト」(平成17~22年度)、JSPS科研費 グラント番号22570114(研究代表者 野村紀通)にて開発した、抗体を用いた結晶化促進技術による研究資源を用いて行われました。
AMED事業
- 創薬等支援技術基盤プラットフォーム事業(PDIS)(平成24~28年度)
- ①創薬等支援のためのタンパク質立体構造解析総合技術基盤プラットフォームによる支援と高度化
(代表機関:高エネルギー加速器研究機構) - ②創薬ターゲットとして重要なヒト膜タンパク質の生産及び結晶化支援基盤
(代表機関:京都大学) - ③タンパク質の複合体構造・相互作用に関する総合的な予測・解析の実施と高度化
(代表機関:東京大学) - 創薬等ライフサイエンス研究支援基盤事業(BINDS)(平成29~33年度[予定])
- ①創薬等ライフサイエンス研究のための相関構造解析プラットフォームによる支援と高度化(PFにおけるタンパク質立体構造解析の支援と高度化、相関構造解析への展開)
(代表機関:高エネルギー加速器研究機構) - ②次世代構造創薬研究を先導するヒト膜タンパク質・抗体の生産技術支援
(代表機関:京都大学) - ③タンパク質の複合体構造・分子間相互作用・ダイナミクス・機能の予測と解析
(代表機関:東京大学)
用語解説
- 注1)多剤排出トランスポーター:
- 細胞膜を介して物質を輸送する膜タンパク質を一般にトランスポーターと呼ぶ。その中には抗生物質など薬剤を排出するトランスポーターも含まれ、特に複数の異なる種類の薬剤を細胞内から細胞外へ輸送するものを多剤排出トランスポーターという。
その中のMFS型の多剤排出トランスポーターは膜の両側のイオン濃度の違いによって形成される電位差をエネルギー源として薬剤などの物質を輸送するグループに属し、多くは12~14回の膜貫通領域を持つ。 - 注2)プロトン化:
- 分子中の酸性や塩基性の官能基にプロトン(水素イオンH+)が結合すること。
- 注3)X線結晶構造解析:
- 生体分子の立体構造を決定するための手法。精製タンパク質を様々な条件下に静置し、タンパク質分子が規則正しく並んだ結晶を作製する。得られた結晶にX線を照射した際に得られる散乱の回折パターンの強度情報から立体構造を計算し、原子モデルを構築する手法。
- 注4)Fabフラグメント:
- 抗体の抗原結合能力を持つ部位でFragment antibody bindingの略。抗体をパパインのようなタンパク質分解酵素で切断して得られる。
- 注5)ペリプラズム領域:
- 大腸菌やサルモネラ菌などに代表されるグラム陰性細菌には、細胞膜が2層ある。1層目の外膜と2層目の内膜の間の空間をペリプラズム領域とよぶ。
- 注6)へリックス:
- タンパク質がもつ二次構造の一つ、らせん型の構造をしており膜貫通領域に多くみられる。
- 注7)リポソーム:(右図)
- 主にリン脂質で構成されており、袋状の構造をしている。生体膜を模した小胞のことであり、
トランスポーター研究においてよく利用される。人工膜小胞ともいう。 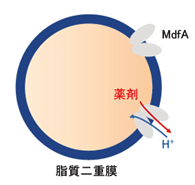
- 注8)クロラムフェニコール:
- 細菌のタンパク質の合成を阻害し、細菌の増殖を抑制する抗生物質のひとつ。
参考図
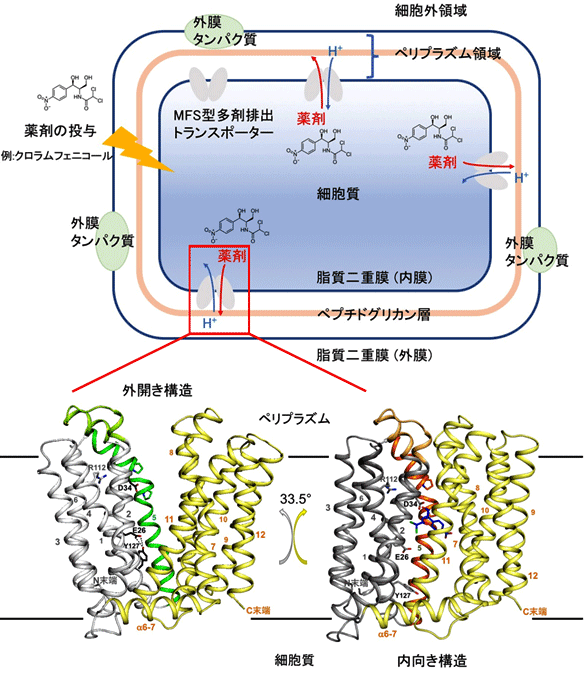
図1 細菌の細胞膜に存在するMFS型多剤排出トランスポーターMdfA
(右)MFS型多剤排出トランスポーターMdfAの構造。それぞれ6本の膜貫通ヘリックスの束によって構成されるN末端側の領域(白/グレー)とC末端側領域(黄)がひとまとまりの剛体として働き、細胞質に対して内向き、外向きの構造のサイクルを繰り返すことで薬剤を結合し、細胞質側からペリプラズム側に排出します。外開き状態の構造(本研究)も、内向き状態の構造(中国のグループによる研究 Heng et al Cell Res. 2015)が得られたことにより、より詳細な構造変化を検証することができました。番号は膜貫通ヘリックスの番号、また重要なアミノ酸を示しています。
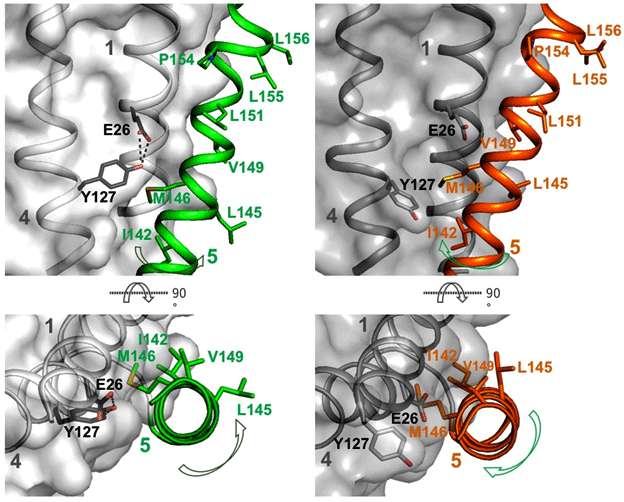
図2 外開き構造から内向き構造への構造変化に伴う5番目膜ヘリックスの捻じれ
お問い合わせ先
研究内容に関すること
大学共同利用機関法人 高エネルギー加速器研究機構
物質構造科学研究所 構造生物学研究センター 特任准教授
田辺 幹雄
Tel:029-879-6176 Fax:029-879-6179
E-mail:mikio.tanabe"AT"kek.jp
国立大学法人 京都大学
大学院医学研究科 教授
岩田 想
Tel:075-753-4372 Fax:075-753-4660
E-mail:s.iwata"AT"mfour.med.kyoto-u.ac.jp
国立大学法人 東京大学
大学院農学生命科学研究科
アグリバイオインフォマティクス教育研究ユニット 准教授
寺田 透
Tel:03-5841-7929 Fax:03-5841-1136
E-mail:tterada"AT"iu.a.u-tokyo.ac.jp
国立大学法人 岡山大学
自然生命科学研究支援センター
ゲノム・プロテオーム解析部門 助教
樹下 成信
Tel:086-251-7262 Fax:086-251-7264
E-mail:n-juge"AT"okayama-u.ac.jp
報道担当
大学共同利用機関法人 高エネルギー加速器研究機構
広報室長 引野 肇
Tel:029-879-6047 Fax:029-879-6049
E-mail:press"AT"kek.jp
国立大学法人 京都大学
総務部 広報課 国際広報室
Tel:075-753-5729 Fax:075-753-2094
E-mail:comms"AT"mail2.adm.kyoto-u.ac.jp
国立大学法人 東京大学
大学院農学生命科学研究科・農学部 総務課 総務チーム(広報情報担当)
Tel:03-5841-5484/8179 Fax:03-5841-5028
E-mail:koho"AT"ofc.a.u-tokyo.ac.jp
国立大学法人 岡山大学
総務・企画部 広報・情報戦略室
井上 直美
Tel:086-251-7292 Fax:086-251-7294
E-mail: inoue-n"AT"adm.okayama-u.ac.jp
AMED事業に関すること
国立研究開発法人 日本医療研究開発機構(AMED)
創薬戦略部 医薬品研究課
Tel:03-6870-2219 Fax:03-6870-2244
E-mail:20-DDLSG-16"AT"amed.go.jp
※E-mailは上記アドレス”AT”の部分を@に変えてください。
関連リンク
掲載日 平成30年10月30日
最終更新日 平成30年10月30日


