成果情報 ゲノム編集による動物受精卵の遺伝子組み換え・遺伝子治療の簡便化に成功
成果情報
東京大学
日本医療研究開発機構
発表者
中内 啓光(東京大学医科学研究所 幹細胞治療部門 特任教授)
山口 智之(東京大学医科学研究所 幹細胞治療部門 特任准教授)
水野 直彬(東京大学医科学研究所 幹細胞治療部門 特任研究員)
発表のポイント
- 哺乳類受精卵へのウイルス感染を利用して、ゲノム編集により簡便に遺伝子組み換えを行う手法を開発した。
- 治療用ウイルスベクターを用いることで、免疫不全マウスの遺伝子治療にも成功した。
- 特殊な技術なしで、ゲノム編集により遺伝子改変動物の作成や、複雑な遺伝子疾患の治療が可能となることが期待される。
発表概要
東京大学医科学研究所の中内啓光特任教授(スタンフォード大学教授兼任)、山口智之特任准教授、水野直彬特任研究員らの研究グループは、アデノ随伴ウイルスベクター(注1)とCRISPR/Cas9ゲノム編集(注2)により、動物胚に外来遺伝子を挿入する新たな技術の開発に成功した。
ゲノム編集技術による遺伝子挿入は、遺伝子改変動物を用いた基礎研究の基盤であるだけでなく、遺伝子疾患の治療にも有用な技術である。近年の技術的進歩により、ゲノム編集技術を受精卵段階で適用することが可能となったが、遺伝子破壊と異なり、遺伝子挿入には高度な手技が必要で、導入できる遺伝子の長さにも制限があった。高効率で簡便な細胞内への遺伝子導入法として、ウイルスベクターを用いた方法が知られているが、一般的な細胞と異なり、哺乳類受精卵は透明帯(注3)に保護されているため、適用することは困難と考えられてきた。
本研究グループは、アデノ随伴ウイルス(AAV)が一般的なウイルスベクターと異なり、さまざまな哺乳類受精卵に対し、透明帯を通過して感染しうることを発見した。この特性を利用して、電気穿孔法(注4)によるCRISPR/Cas9ゲノム編集に、アデノ随伴ウイルスベクターによるドナーDNAの導入を組み合わせることで、特殊な機材・技術を用いることなく、受精卵段階で長鎖外来遺伝子をノックインする事に成功した。さらに同手法を用いて、免疫不全モデル動物であるヌードマウスの遺伝子治療にも成功した。
本手法はマウス・ラットだけでなく、牛をはじめとする家畜など、広範な哺乳類に適用可能と考えられ、生物学・医学研究において基盤的な技術となりうると共に、遺伝子疾患をもつ家畜等において遺伝子治療を可能とすると期待される。
本研究成果は 2018年11月2日付の科学雑誌 「iScience」のオンライン版に掲載された。
発表内容
近年ゲノム編集技術の発達により、受精卵段階で動物胚の遺伝子を改変する事が可能となり、遺伝子改変実験動物の作成や遺伝子治療への応用が期待されている。遺伝子改変は、標的とした遺伝子を切断し修復時に微小なエラーを生じさせて機能を破壊するノックアウトと、外部から任意の配列を挿入して事前設計した通りの機能を与えるノックインに大別される。外来遺伝子をもった動物の作成や遺伝子治療には後者の技術が必要である。しかし、動物胚への遺伝子ノックインには、マイクロインジェクション法(注5)といった特殊な技術が必要であったり、ゲノムDNAに挿入する核酸(ドナーDNA)が効率よく細胞核に輸送されず、ゲノムに組み込まれるまでの間に分解されてしまうなどの理由から、長い配列を導入する事が困難という限界があった。
本研究では、電気穿孔法によるCRISPR/Cas9ゲノム編集に、アデノ随伴ウイルスベクターによるドナーDNAの導入を組み合わせることで、特殊な機材・技術を用いることなく、ノックインマウスおよびノックインラットを作成することに成功した。ウイルスは細胞に感染後、細胞核に自身のゲノムを誘導する機構を有しており、培養細胞等で遺伝子導入する際には高い効率を示す。しかし、子宮着床前の受精卵は透明帯に保護されており、単純に暴露しただけではウイルスは感染しないと考えられてきたため、受精卵の遺伝子改変にほとんど利用されていなかった。本研究グループは、アデノ随伴ウイルスが透明帯に阻害されることなく哺乳類の受精卵に感染することを発見した。この特性を利用し、アデノ随伴ウイルスをドナーDNAのベクター(運び屋)とする事で、1細胞期受精卵ゲノムに長鎖外来遺伝子をノックインし、短期間で高効率に遺伝子改変マウスと遺伝子改変ラットを作成することに成功した。さらに、同様の手法を用いて、免疫不全モデル動物であるヌードマウスの変異遺伝子Foxn1を遺伝子修復し、正常な免疫系を獲得させることにも成功した。
本手法は広範な哺乳類に適用可能と考えられ、生物学・医学研究において基盤的な技術となりうると共に、遺伝子疾患をもつ家畜等において遺伝子治療を可能とすると期待される。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業インキュベートタイプ(LEAP)における研究開発課題「発生原理に基づく機能的立体臓器再生技術の開発」(研究開発代表者:中内啓光)の一環として行われた。
発表雑誌
- 雑誌名:
- iScience 11月2日付オンライン版
- 論文タイトル:
- Intra-embryo gene cassette knock-in by CRISPR/Cas9-mediated genome editing with adeno-associated viral vector.
- 著者:
- Naoaki Mizuno, Eiji Mizutani, Hideyuki Sato, Mariko Kasai, Aki Ogawa, Fabian Suchy, Tomoyuki Yamaguchi and Hiromitsu Nakauchi.
- DOI番号:
- 10.1016/j.isci.2018.10.030
- アブストラクトURL:
- https://doi.org/10.1016/j.isci.2018.10.030
用語解説
- (注1)アデノ随伴ウイルスベクター:
- 一本鎖DNAウイルス。ヒトへの感染性を有するが、明らかな病原性は示さない。また、アデノウイルスと共感染しない限り自己複製しない。野生型アデノ随伴ウイルスは、ヒトゲノムDNAの特定領域(AAVS1)に挿入される特性を持つが、研究用・臨床用に用いられるベクターは、遺伝子改変によりその性質を欠失している。ウイルスの殻(カプシド)のタイプ(血清型)により、感染しやすい臓器・組織の種類が異なる。遺伝子治療に有用と考えられており、血液疾患等での臨床試験が行われている。
- (注2)CRISPR/Cas9ゲノム編集:
- 原核生物の有する獲得免疫機構であるCRISPR/Cas9システムをもとに開発された遺伝子改変技術。ガイドRNA(gRNA)という標的を指定するRNAと、二本鎖DNA切断活性を有するCas9タンパクを細胞内に導入すると、核に移行した後、gRNAと相補的なゲノムが特異的に切断される。切断されたゲノムDNAは細胞が元々持っているゲノム修復機構で繋ぎなおされるが、この際に微小なエラーが生じる事がある。また外部から挿入したい核酸(ドナーDNA)を導入しておくと、高い確率で切断箇所に組み込まれる。
- (注3)透明帯:
- 子宮着床前の受精卵を取り囲む、糖タンパクの膜。ウイルスなど異物の侵入を防ぐ、子宮到達前に卵管壁に胚が接着するのを防ぐなどの役割がある。
- (注4)電気穿孔法:
- 短時間、高電圧を細胞にかけることで、細胞膜に穴をあけて外部から核酸(DNA、RNA)やタンパクを導入する方法。
- (注5)マイクロインジェクション法:
- 顕微鏡観察下で、微細なガラス針を用いて、細胞内の狙った場所に試料を導入する手法。非常に高度な専門手技であり、成功率は術者の技量に依存する。
添付資料
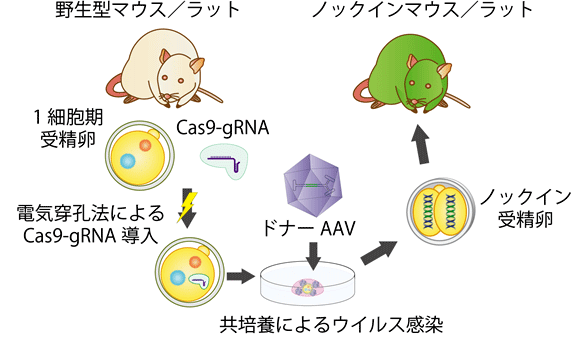
図1.本研究の概略図
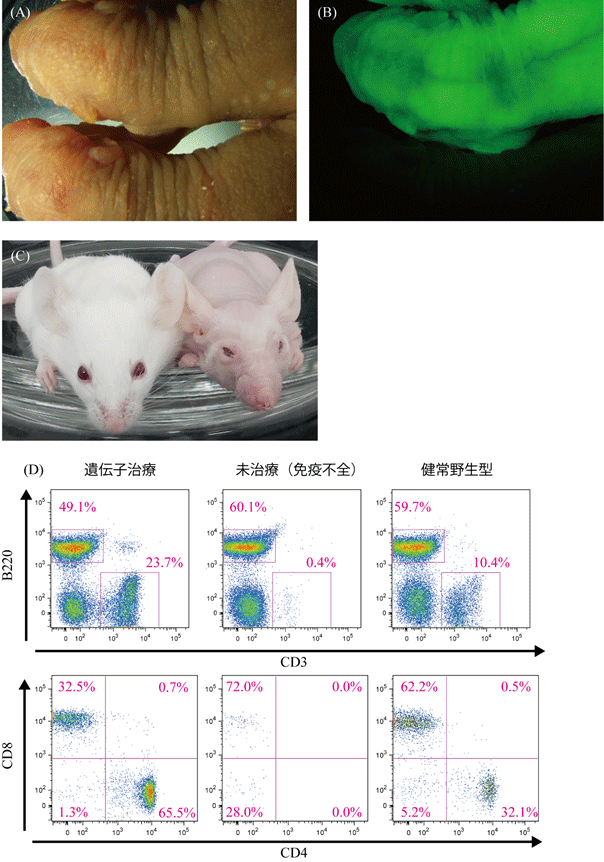
図2.マウス、ラットでの遺伝子挿入と遺伝子治療。
(C)(D)ヌードマウスの遺伝子治療。ヌードマウスはFoxn1遺伝子の変異により、無毛、免疫不全等の異常を呈する。ヌードマウスの受精卵において、アデノ随伴ウイルスベクターで変異型Foxn1遺伝子を正常型Foxn1遺伝子に修復したところ、これらの異常は治療された。(C)治療個体(左)は未治療個体(右)と違い、全身で発毛を認める。(D)ヌードマウスでは血液中にT細胞(CD3陽性細胞)を認めないが、治療個体ではT細胞を認める。このT細胞はCD4陽性細胞(ヘルパーT細胞)、CD8陽性細胞(キラーT細胞)に正常分化している。
問い合わせ先
研究に関する問い合わせ先
東京大学医科学研究所 幹細胞治療部門
特任准教授 山口 智之 (ヤマグチ トモユキ)
特任研究員 水野 直彬 (ミズノ ナオアキ)
東京都港区白金台4-6-1
Tel:03-5449-5129
E-mail:tomoyama"AT"ims.u-tokyo.ac.jp(山口)
nmizuno1"AT"ims.u-tokyo.ac.jp(水野)
AMED事業に関する問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課
東京都千代田区大手町1-7-1読売新聞ビル
Tel:03-6870-2224
E-mail:kenkyuk-ask"AT"amed.go.jp
※E-mailは上記アドレス”AT”の部分を@に変えてください。
掲載日 平成30年11月6日
最終更新日 平成30年11月6日


