成果情報 統合失調症やパーキンソン病の治療薬の標的の構造解明―副作用を抑えた薬の合理的な探索・設計が可能に―
成果情報
国立大学法人京都大学
国立大学法人東北大学
国立研究開発法人日本医療研究開発機構
概要
京都大学大学院医学研究科 島村達郎 特定講師、岩田想 同教授、木村香菜子 同研究員らの研究グループは、東北大学大学院薬学研究科 井上飛鳥 准教授、青木淳賢 同教授らとの共同研究により、セロトニン2A受容体の立体構造を、X線結晶構造解析の手法を用いて世界で初めて解明しました。セロトニン2A受容体は、統合失調症や、パーキンソン病の精神症状(幻覚・妄想)などに対する治療薬が作用するタンパク質です。これらの薬には、セロトニン2A受容体と類似する他の受容体にも作用することで発生する副作用が知られています。
本研究では、セロトニン2A受容体に薬が結合する部位の近くに、セロトニン2A受容体に特有の構造が存在することがわかりました。今後は、セロトニン2A受容体の原子レベルの構造情報を基に、より有効性が高く副作用の少ない治療薬の探索・設計が可能になると期待されます。
本研究成果は、2019年2月5日に国際学術誌「Nature Structural & Molecular Biology」にオンライン掲載されました。
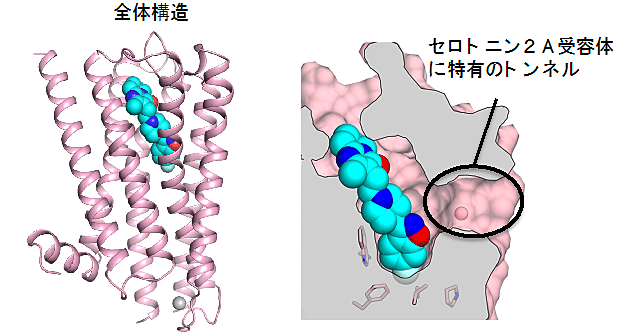
図 セロトニン2A受容体の全体構造(左)と断面図(右)
1.背景
統合失調症は100人に1人程度がかかる精神疾患です。統合失調症の症状には、妄想・幻覚や意欲の低下などがあります。現在、統合失調症の治療薬として主に使用されているのは、非定型抗精神病薬と呼ばれる薬です。これらの薬は、脳に存在するドパミンD2受容体とセロトニン2A受容体という2種類のタンパク質の機能を抑制する(不活性化する)ことで効果を発揮しています。しかし、ドパミンD2受容体やセロトニン2A受容体と類似する他のアミン受容体にも結合して不活性化してしまうことが原因となり、眠気、体重増加、高血糖、起立性低血圧などの副作用が存在します。
高齢者に多いパーキンソン病は、手足の震えなどの運動症状が主な症状ですが、30%程度の患者さんでは妄想・幻覚などの精神症状も見られます。この精神症状の治療薬もセロトニン2A受容体を不活性化します。しかしこのような薬は、ドパミンD2受容体を含めた他のアミン受容体にも作用すると副作用が生じます。
副作用が少ない薬の開発には、標的となっているセロトニン2A受容体の立体構造情報が役に立ちます。実際に、近年の創薬分野では、標的タンパク質の立体構造を基にした創薬戦略(Structure-based drug design)が進められています。しかしセロトニン2A受容体は膜タンパク質であるため精製や結晶化が困難で、これまで立体構造が解明されていません。そこで本研究では、より副作用が少なく高い効果を持つ新しい薬の探索・設計に貢献するため、私たちのこれまでの膜タンパク質の構造解析経験を活かし、セロトニン2A受容体の立体構造の解明を試みました。
2.研究手法・成果
本研究では、ヒト由来のセロトニン2A受容体に非定型抗精神病薬であるリスペリドンもしくはゾテピンが結合した複合体の立体構造を、X線結晶構造解析の手法を用いて原子レベルで解明しました。そのためにまず、昆虫細胞を用いてセロトニン2A受容体の大量生産系を構築しました。その際には、独自に設計した安定性の高い水溶性タンパク質をセロトニン2A受容体の不安定な部分と置換し、セロトニン2A受容体を安定化させました。X線回折実験およびデータ収集は、日本医療研究開発機構(AMED)の創薬等先端技術支援基盤プラットフォーム(BINDS)の支援を受け、大型放射光施設であるSPring-8のビームラインBL32XUで行いました。
セロトニン2A受容体の全体構造は、他のアミン受容体とよく似た構造をとっていました(図1a)。リスペリドンやゾテピンは、アミン受容体ファミリーで高度に保存されている残基に囲まれていました(図1b)。このことは、抗精神病薬が他のアミン受容体にも結合し、副作用を生じる原因の一つであると考えられます。一方でセロトニン2A受容体は、薬剤結合部位の近くに細胞膜まで貫通したトンネルを持っていました。このトンネルは、最もよく構造が似ているセロトニン2C受容体を含め、既に決定されている他のアミン受容体には存在しませんでした(図1c)。
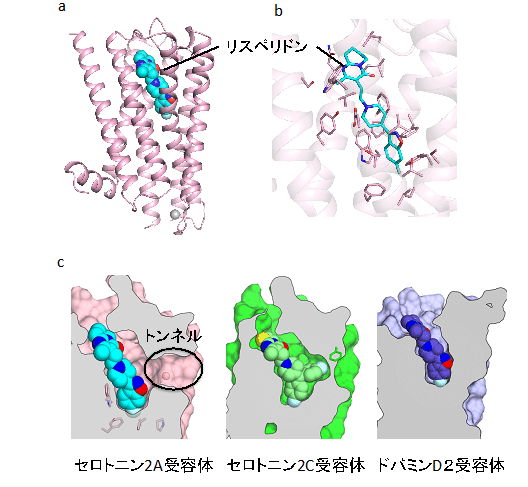
図1 セロトニン2A受容体の構造
次に、セロトニン2A受容体の立体構造情報を用いて、セロトニン2A受容体に特異的に結合し不活性化するピマバンセリンのドッキング計算を行いました。ピマバンセリンは、パーキンソン病の精神症状に対して認可されている唯一の薬です。その結果、ピマバンセリンはセロトニン2A受容体に特有のトンネルに結合しており(図2)、この結合様式により、ピマバンセリンはセロトニン2A受容体に対して選択的に高い親和性を示すことが示唆されました。この結合様式は、変異体実験の結果からも支持されました。
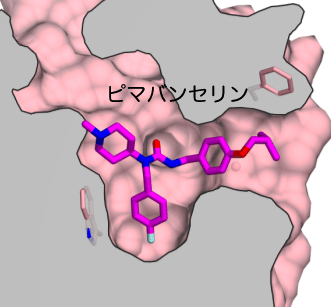
図2 ピマバンセリンのドッキングモデル
ピマバンセリンはセロトニン2A受容体のトンネルに結合することが示唆されました。
3.波及効果、今後の予定
本研究の結果により、セロトニン2A受容体について、薬の結合部位の詳細な構造情報が取得できました。今後はこれらの立体構造の情報をもとに、セロトニン2A受容体を標的とする副作用を抑えた薬の合理的な探索・設計が可能になると考えられ、統合失調症やパーキンソン病の治療薬の迅速な開発への貢献が期待されます。
4.研究プロジェクトについて
本研究は、日本学術振興会(JSPS)の科学研究費助成事業、三菱財団、日本医療研究開発機構(AMED)の創薬等先端技術支援基盤プラットフォーム(BINDS)など多くの支援を受けています。
研究者のコメント
本研究ではセロトニン2A受容体の構造解析に成功しました。この構造情報が、将来の新しい薬の開発に役立つことを期待しています。私たちが構造解析研究を行っている受容体は、生命に必須の役割を果たし、また、多くの病気に関与します。今後は他の受容体の構造も解明して研究を発展させ、生命現象の理解や創薬に貢献したいと考えています。
論文タイトルと著者
- タイトル:
- Structures of the 5-HT2A receptor in complex with the antipsychotics risperidone and zotepine.
(セロトニン2A受容体に抗精神病薬であるリスペリドン・ゾテピンが結合した状態の構造解析) - 著者:
- Kanako Terakado Kimura, Hidetsugu Asada, Asuka Inoue, Francois Marie Ngako Kadji, Dohyun Im, Chihiro Mori, Takatoshi Arakawa, Kunio Hirata, Yayoi Nomura, Norimichi Nomura, Junken Aoki, So Iwata, Tatsuro Shimamura
- 掲載誌:
- Nature Structural & Molecular Biology
- DOI:
- 10.1038/s41594-018-0180-z
AMED事業
- 事業名:
- 創薬等ライフサイエンス研究支援基盤事業(2017~2021年度(予定))
- 課題名:
- 次世代構造創薬研究を先導するヒト膜タンパク質・抗体の生産技術支援
- 代表機関:
- 京都大学
お問い合わせ先
研究に関するお問い合わせ
京都大学大学院医学研究科
特定講師 島村 達郎
TEL:075-753-4389 FAX:075-753-4660
E-mail:t.shimamura"AT"mfour.med.kyoto-u.ac.jp
報道に関するお問い合わせ
京都大学総務部広報課 国際広報室
TEL:075-753-5729 FAX:075-753-2094
東北大学大学院薬学研究科
分子細胞生化学分野 准教授 井上飛鳥
TEL:022-795-6861 FAX:022-795-6859
E-mail:iaska"AT"m.tohoku.ac.jp
AMED事業に関するお問い合わせ
AMED創薬戦略部医薬品研究課
TEL:03-6870-2219 FAX:03-6870-2244
E-mail:20-DDLSG-16"AT"amed.go.jp
※上記E-mailの"AT"の部分を@に変えてください。
掲載日 平成31年2月14日
最終更新日 平成31年2月14日


