成果情報 環境化学物質によるタンパク質脱イオウ化が心不全リスク増大の原因に!―心不全の新たな予防・治療薬の開発に期待―
成果情報
自然科学研究機構 生理学研究所 研究力強化戦略室
自然科学研究機構 生命創成探究センター
九州大学
日本医療研究開発機構
概要
慢性心不全は、低下傾向にある心機能の急性増悪(急性心不全)を繰り返す危険な病態です。今回、自然科学研究機構生理学研究所(生命創成探究センター)および九州大学大学院薬学研究院の西田基宏教授は、筑波大学、東北大学、国立医薬品食品衛生研究所との共同研究により、環境化学物質の一つであるメチル水銀(MeHg)の低濃度曝露が心不全モデルマウスの病態を悪化させる分子機構を明らかにしました。MeHgはミトコンドリア分裂促進タンパク質Drp1のポリイオウ鎖注1)と化学反応し、イオウを引き抜く(脱イオウ化)ことでミトコンドリア分裂および圧負荷で誘発される心不全の病態を増悪させることを見出しました。さらに、イオウドナー注2)投与により、MeHgによる心不全悪化を解除することに成功しました。
本研究成果は、タンパク質ポリイオウ量が環境化学物質による疾患発症リスクを規定する重要な指標となることを示すとともに、新たな心不全の予防・治療法の開発にも大きく貢献することが期待されます。
本研究成果はScience Signaling電子版(日本時間2019年6月26日午前4時解禁)に掲載されました。
研究成果の内容
疾患が起きる原因には、遺伝的要因と環境要因があり、疫学調査の結果から、環境要因が疾患の原因の90%を占めることが示唆されています。私たちは日々の生活の中で多くの環境化学物質に曝されており、こうした環境化学物質の蓄積が疾患発症リスクを高める原因になると考えられています。マグロや鯨、カジキなどに含まれる微量の有機水銀も環境危険因子の一つであり、有機水銀の過剰摂取・体内蓄積が疾患リスクを高める原因となる可能性が指摘されているものの、その詳細な分子機構についてはよくわかっていませんでした。
私たちの研究グループは、心不全を増悪させる要因として心筋細胞の早期老化現象に着目してきました。加齢とともに増加する心筋細胞の老化は、心臓の機能(収縮力)を低下させます。我々は昨年、心筋細胞の早期老化が起こるメカニズムとして、ミトコンドリアの異常分裂が引き金となっていることを報告しました。ミトコンドリアはエネルギー産生の中心を担う細胞内小器官であり、分裂と融合を繰り返すことで自身の品質(機能)を維持しています。今回の研究では、環境化学物質の一つであるメチル水銀(MeHg)が心筋細胞に与える影響を調べるために、食事摂取で上昇しうるレベルの極めて低濃度のMeHgをマウスに曝露させました。その結果、行動異常や体重減少などの変化は全く認められないものの、大動脈狭窄による圧負荷に対する心臓のストレス抵抗性が著しく減弱しており(図1)、心機能低下(心不全)や死亡率の増加がみられました。また、MeHg曝露マウスの心筋組織では、ミトコンドリア分裂促進分子Dynamin-related protein 1 (Drp1)が異常に活性化しており、それに伴ってミトコンドリアの異常分裂が誘導されていることも明らかとなりました。
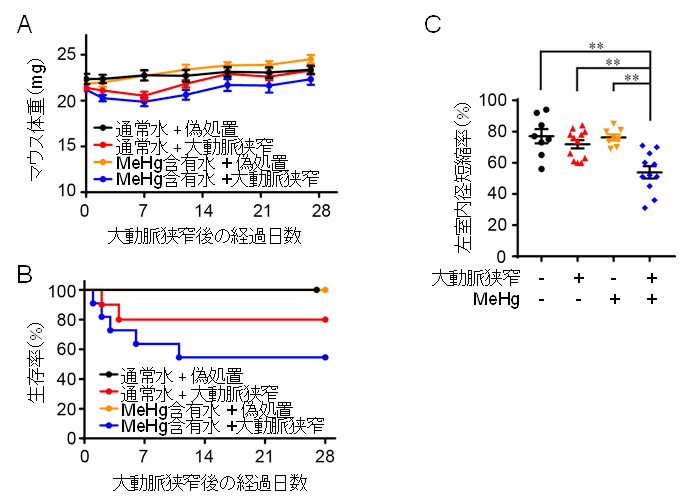
図1:MeHg曝露マウスは圧負荷刺激に対して脆弱になる。
(C)圧負荷誘発後1週間における左室内径短縮率(心機能の指標)を測定した。
私たちの以前の研究から、Drp1異常活性化はアクチン結合蛋白質注3)であるFilamin注4)とDrp1 が複合体を形成することによって誘導されること、既承認薬シルニジピン注5)(ジヒドロピリジン系カルシウム拮抗薬)は、Drp1-Filamin複合体形成を抑制することで、Drp1異常活性化を抑制することが明らかになっています。そこで今回、Drp1異常活性化を起こしているMeHg曝露心筋細胞にシルニジピンを投与したところ、心筋細胞のストレス脆弱性が解除されました。これらの結果から、MeHg曝露によるDrp1異常活性化は、Drp1-Filaminタンパク質間相互作用が強まることによって引き起こされていることが示唆されました(図2)。
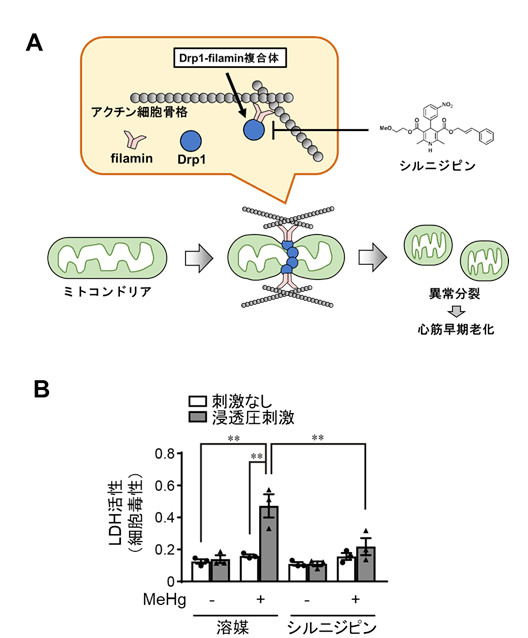
図2:MeHg曝露心筋細胞のストレス脆弱性とシルニジピンによる抑制効果。
(B)MeHg曝露心筋細胞の浸透圧刺激脆弱性。
さらに分子メカニズムを詳細に解析したところ、Drp1タンパク質のC末端に存在するシステイン注6)(Cys-624)の側鎖がポリイオウ鎖を形成しており、MeHgは、このポリイオウ鎖と化学的に反応しイオウを引き抜く(脱イオウ化する)こと、そしてこの脱イオウ化によって、Drp1-Filaminタンパク質間相互作用が強まり、Drp1が活性化することが明らかになりました。そこで、Drp1ポリイオウ鎖を保護するために、硫化水素ナトリウム(NaHS)などのイオウドナーを投与したところ、MeHgによる心不全悪化を解除することに成功しました(図3)。
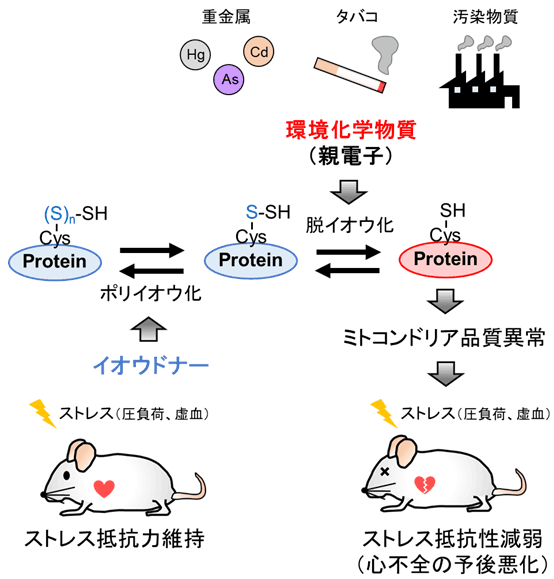
図3:本研究内容の概略図。
本研究により、MeHgなど親電子性の高い環境化学物質がタンパク質ポリイオウ鎖を標的として脱イオウ化することでタンパク質の機能を修飾し、ミトコンドリア品質異常を伴う心臓のストレス抵抗性減弱、ひいては心不全の予後悪化を引き起こす原因となることを明らかにしました。また、生体外からイオウを供給しポリイオウ鎖を保護することで、心不全発症リスクが軽減されうる可能性が示されました。 本研究は、科学研究費補助金、日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業「創薬等先端技術支援基盤プラットフォーム(BINDS)」、細胞科学財団の支援を受けて行われました。
用語説明
- 注1)ポリイオウ鎖:
- イオウ原子(S)が2つ以上結合した分子。ここではイオウ原子を含むアミノ酸(システイン)のSH官能基にSが付加したシステインパースルフィド(Cys-SSH)やシステインポリスルフィド(Cys-SS(n)H)を指す。東北大・赤池孝章教授らが活性酸素の代謝・消去を担う実体として最初に報告した。
- 注2)イオウドナー:
- Sを供与しうる小分子化合物。NaHSやH₂Sなど。
- 注3)アクチン結合蛋白質:
- 細胞骨格タンパク質アクチンと結合する蛋白質。
- 注4)Filamin:
- 約270kDaの蛋白質分子。アクチン蛋白質と結合すると同時にFilamin同士も2量体を形成し、アクチン線維を架橋(凝集)する。
- 注5)シルニジピン:
- ジヒドロピリジン骨格をもつ電位依存性L/N型カルシウムチャネル阻害薬。高血圧治療薬として使われている。
- 注6)システイン:
- イオウ原子を含むアミノ酸の一つ。側鎖にSH官能基を持ち、ここでポリイオウ鎖が形成される。
今回の発見
- 低濃度MeHg曝露が心筋細胞のミトコンドリア分裂を誘導することを見出しました。
- MeHg曝露マウスでは、圧負荷による心臓のストレス抵抗性が減弱し、著しい心機能低下(心不全)や死亡率の増加が観察されました。
- MeHgはミトコンドリア分裂促進タンパク質Drp1のシステインポリイオウ鎖と反応し、脱イオウ化することでミトコンドリア過剰分裂を誘導すること、ポリイオウ鎖の保護によりMeHg心毒性を軽減できることが明らかとなりました。
この研究の社会的意義
環境化学物質による心不全増悪のメカニズムは心臓にとどまった話ではなく、様々な環境因子による疾患発症・増悪リスクの分子機構解明にもつながり、タンパク質ポリイオウ鎖の保護を主眼とする新たな治療薬の開発が期待されます。また、ヒト体内・細胞内のタンパク質ポリイオウ鎖レベルを調べることで、細胞・組織のストレス抵抗性を予測することも可能となり、ひいては未病の診断(予防医学)への貢献なども期待できます。
論文情報
- 著者
- Nishimura A, Shimoda K, Tanaka T, Toyama T, Nishiyama K, Shinkai Y, Numaga-Tomita T, Yamazaki D, Kanda Y, Akaike T, Kumagai Y and Nishida M.
- 論文タイトル
- Depolysulfidation of Drp1 induced by low-dose methylmercury exposure increases cardiac vulnerability to hemodynamic overload.
- 発表雑誌
- Science Signaling(日本時間2019年6月26日午前4時掲載)
AMED事業
- 事業名:
- 創薬等ライフサイエンス研究支援基盤事業(2017~2021年度(予定))
- 課題名:
- グリーンファルマを基盤にした創薬オープンイノベーションの推進
- 代表機関名:
- 九州大学
お問い合わせ先
研究について
大学共同利用機関法人 自然科学研究機構 生理学研究所 心循環シグナル研究部門
国立大学法人 九州大学 大学院薬学研究院 創薬育薬研究施設統括室
教授 西田 基宏(ニシダ モトヒロ)
TEL:0564-59-5560
E-mail:nishida"AT"nips.ac.jp
AMED事業について
国立研究開発法人 日本医療研究開発機構(AMED)
創薬戦略部 医薬品研究課
TEL:03-6870-2219
E-mail:20-DDLSG-16"AT"amed.go.jp
※Emailは上記アドレス"AT"の部分を@に変えてください。
掲載日 令和元年7月12日
最終更新日 令和元年7月12日


