成果情報 オートファジーを選択的に制御できるAUTAC分子の発明―細胞内の有害物質を取り除く創薬手法を開発―
成果情報
国立大学法人 東北大学大学院生命科学研究科
国立研究開発法人 日本医療研究開発機構
オートファジーは、我が国が強みを持つ研究領域であり、創薬への応用にも期待が高まっています。しかしながら、既存のオートファジー活性化剤は、分解する相手を選ぶ能力を持たない短所がありました。
東北大学大学院生命科学研究科 有本博一教授,高橋大輝研究員らは、オートファジーの創薬への応用を容易にする新分子AUTAC(autophagy-targeting chimera:オータック)1)を発明しました。AUTACは、細胞内に存在する特定の物質を狙い撃ちすることによって、選択的にオートファジーで分解します。例えば、ミトコンドリアに障害がある患者由来の細胞に対するAUTACをデザインすると、短期間の処理でミトコンドリアの機能や形態に顕著な改善をもたらします。
AUTACは、多様な疾患の標的に対して個別にデザインできることから、幅広い応用が考えられ、今後の創薬研究の手法を大きく変える可能性があります。
研究開発のポイント
- 疾患の原因となる有害なタンパク質や機能不全のミトコンドリアなどを、選択的に取り除く分子AUTAC(オータック)を発明した。
- 疾患の原因となる物質の選択的な分解は、特に製薬企業において活用が期待される。
- AUTACは、我が国が伝統的に強いオートファジー研究の最新成果をもとにデザインされた。
研究概要
オートファジーは、2016年に大隅良典教授がノーベル賞を授与されたことで知られています。機能不全に陥った細胞小器官、細胞外から侵入する病原体、タンパク質凝集体など多様な相手を分解できます(図1)。
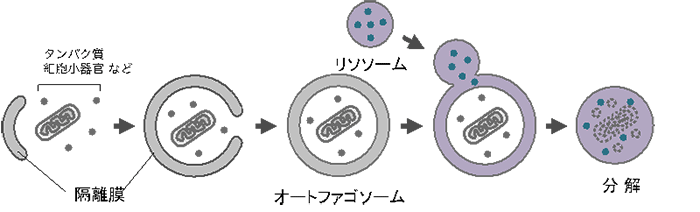
図1.オートファジー
今回の研究では、オートファジー機構を利用して、細胞内にある疾患の標的を分解することを目指しました。まず、「オートファジーを呼び寄せる働き」を持つ化学構造(グアニン誘導体)を発見しました(下図では赤い五角形で表現しています)。続いて、疾患に関係する相手に結合する「標的化リガンド(下図では青色)」を用意し、両者を結合してAUTACを作りました(図2)。
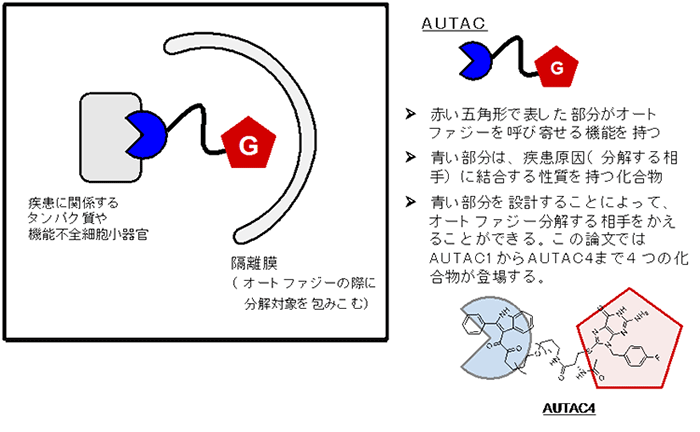
図2.AUTACが疾病原因物質を分解する模式図
例えば、AUTAC2は、細胞内のFKBP12タンパク質2)の量を約70%減少させることが分かりました(図3)。また、AUTAC4はミトコンドリアの表面に結合するように設計されています(図2)。
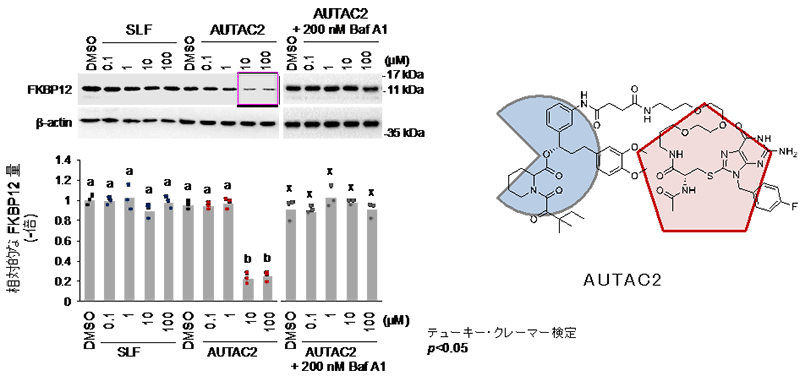
図3.AUTAC2による標的タンパク質(FKBP12)の分解(HeLa細胞)
ミトコンドリアは、エネルギーの通貨(ATP)を合成するほか、細胞の生死を決定づける機能も持っています。疾患や老化によって機能低下が進むとミトコンドリアは小さく断片化することが知られていました。そこで、疾患患者から樹立された線維芽細胞株Detroit 532にAUTAC4を3日間投与したところ、ミトコンドリアの機能(膜電位、ATP産生)が顕著に改善しました。また、AUTAC4の投与前に存在していた断片化したミトコンドリアは除去され、ネットワーク状の健康な形態3)に復帰することも確認できました。(図4)
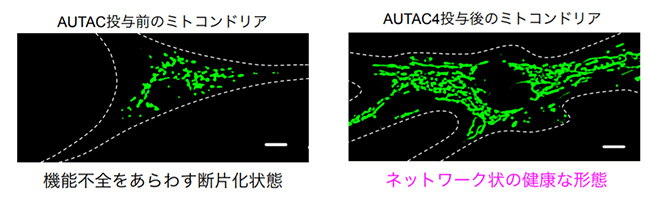
図4.AUTAC4によるミトコンドリア機能の改善
今回発明したAUTACは、オートファジーを活性化させ、多彩な対象を選んで分解し除去できる世界初の化合物といえます。オートファジーは多様な物質の分解に応用できるため、製薬会社において、それぞれの疾患に合わせたAUTACが研究されていくと期待されます。この技術は東北大学より国際特許出願がなされています。
なお、本研究成果は、米国の主要科学誌『モレキュラー・セル』 (Molecular Cell) オンライン版に日本時間10月10日に発表されました。
用語解説
- 1)キメラ分子
- AUTACのCは英語のChimeraの意。キメラ分子とは、2つの機能を有する化学構造が連結された分子。AUTACは、分解する相手に結合する標的化リガンドと、オートファジーを呼び寄せるグアニン誘導体の2つが連結されたキメラ分子。
- 2)FKBP12
- 免疫抑制剤であるタクロリムス(化合物名:FK506)が結合するタンパク質のひとつ。
- 3)ミトコンドリアの形態
- ミトコンドリアは、イラストとして俵状に描かれることが多いが、実際には互いに融合して長く繋がり、さらに枝分かれをしてネットワーク状の形態を示す。ミトコンドリアは動的に融合と断片化を繰り返しているが、機能が低下すると断片化した割合が上昇する。
特記事項
本研究の一部は、科学研究費補助金・助成金、日本医療研究開発機構(AMED)「次世代治療・診断実現のための創薬基盤技術開発事業」(革新的中分子創薬技術の開発)、内藤記念科学振興財団、上原生命科学財団の助成を受けて実施されました。
論文情報
- 雑誌名:
- Molecular Cell(2019年10月9日オンライン版)
- 論文タイトル:
- AUTACs: Cargo-Specific Degraders Using Selective Autophagy
- 著者:
- Daiki Takahashi, Jun Moriyama, Tomoe Nakamura, Erika Miki, Eriko Takahashi, Ayami Sato, Takaaki Akaike, Kaori Itto-Nakama, and Hirokazu Arimoto
- DOI番号:
- https://doi.org/10.1016/j.molcel.2019.09.009
お問い合わせ先
内容に関するお問い合わせ
国立大学法人東北大学大学院生命科学研究科
教授 有本 博一(ありもと ひろかず)
TEL:022-217-6201
E-mail:arimoto“AT”tohoku.ac.jp
AMEDの事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構
創薬戦略部 医薬品研究課
次世代治療・診断実現のための創薬基盤技術開発事業担当
TEL:03-6870-2219
E-mail:jisedai-med“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和元年11月11日
最終更新日 令和元年11月11日


