成果情報 Nrf2の活性化によるアルツハイマー病の改善作用の解明―酸化ストレスや炎症を標的とした新しい治療法に向けて―
成果情報
国立大学法人東北大学東北メディカル・メガバンク機構
国立大学法人東北大学大学院医学系研究科
国立大学法人東北大学加齢医学研究所
国立研究開発法人日本医療研究開発機構
発表のポイント
- 転写因子※1Nrf2の活性化について、遺伝子改変※2を利用した正確性の高い解析手法を用いて、Nrf2がアルツハイマー病※3モデルマウスの病態を改善することを明らかにしました。
- Nrf2を活性化することにより、アルツハイマー病モデルマウスの脳内の酸化ストレス※4と炎症を抑制して、認知機能の障害を改善しました。
- Nrf2活性化作用をもつ天然化合物の投与も、アルツハイマー病モデルマウスの病態を改善させたことから、アルツハイマー病の薬物治療に結びつく新たな知見が得られました。
研究概要
東北大学の宇留野 晃准教授(東北メディカル・メガバンク機構)、松丸 大輔助教(遺伝子実験センター、現・岐阜薬科大学)、山本 雅之教授(医学系研究科/東北メディカル・メガバンク機構 機構長)らは、川島 隆太教授(加齢医学研究所 所長)らと協力して、アルツハイマー病の新たな治療へのアプローチに繋がる知見を得ました。
アルツハイマー病では、脳内で発生する酸化ストレスや炎症が、病態を悪化させることが知られてきました。転写因子Nrf2は、酸化ストレスを軽減するための遺伝子の発現を増加させたり、病的な炎症を引き起こす遺伝子の発現を低下させることで、さまざまなストレスから細胞を保護する役割を果たしています。その結果、Nrf2は多くの病気の予防に貢献していますが、アルツハイマー病におけるNrf2の活性化の効果は知られていませんでした。
今回の研究では、遺伝子改変によってNrf2を活性化する解析方法に加えて、ワサビに含まれる天然化合物6-メチルスルフィニルヘキシルイソチオシアネート(6-MSITC)の投与によってNrf2を活性化する解析方法を用いて、Nrf2によるアルツハイマー病モデルマウスの病態改善作用を検討しました。その結果、遺伝子改変によるNrf2活性化が、アルツハイマー病モデルマウスの脳内の酸化ストレスや炎症を抑制して、その病態が改善することがわかりました。さらに、天然化合物である6-MSITC投与によるNrf2活性化も、アルツハイマー病を改善させることが明らかとなりました。
現在、Nrf2を活性化する薬剤が多発性硬化症※5の治療に利用され、さらに糖尿病に合併した慢性腎臓病※6に対する臨床試験が進められています。本研究で得られた知見を利用することで、アルツハイマー病の新しい治療法の開発が進むことが期待されます。この成果は米国時間2020年1月13日に米国科学雑誌「Molecular and Cellular Biology」のオンライン版で公開されました。
本研究の詳細
我が国では高齢化に伴い、認知症が増加しています。アルツハイマー病は認知症の主な原因であるため社会的に重要な疾患ですが、治療の有効性が十分ではないことから、新しい治療法の開発が待たれています。以前より、アルツハイマー病の脳では、酸化ストレスや炎症が増加することが知られてきましたが、それらを標的とした治療の有効性については、十分に解明されていませんでした。
Nrf2は酸化ストレスなどの発生に伴い、ストレスに応答して活性化される転写因子ですが、抗酸化酵素や解毒代謝酵素の遺伝子発現を増加させたり、炎症を引き起こすサイトカイン※7の遺伝子発現を低下させる働きをしています。このためNrf2の活性化は、アルツハイマー病で発生する酸化ストレスや炎症を抑制して、その病態を改善することが予想されていましたが、研究成果として証明はされていませんでした。
Nrf2は、他の分子から電子を奪う性質の「親電子性分子」により活性化されます。このような分子の利用は、Nrf2活性化の効果を解析するためには有用ですが、Nrf2以外にも影響を及ぼすことが知られています。本研究では、Nrf2の役割を正確に解析するために、Nrf2を調節しているKeap1の遺伝子を改変したKeap1FA/FAマウス※8を用いました。Keap1FA/FAマウスはKeap1の発現量が低いことが特徴ですが、Keap1はNrf2を抑制する役割を持つことから、Keap1FA/FAマウスではNrf2が活性化されています。また、アルツハイマー病モデルとして、理化学研究所脳神経科学研究センターの西道隆臣チームリーダーらにより開発された、アミロイド前駆タンパク質(APP)の遺伝子変異ノックインマウス※9であるAppNLGFマウス※10を利用しました。これらのマウスを組み合わせたAppNLGF::Keap1FA/FAマウスを解析することで、Nrf2活性化のアルツハイマー病に対する効果を、より正確に同定することに成功しました。
アルツハイマー病モデルであるAppNLGFマウスでは、認知機能の障害を認めましたが、Nrf2活性化アルツハイマー病モデルのAppNLGF::Keap1FA/FAマウスでは、認知機能の障害が改善していました。AppNLGF::Keap1FA/FAマウスの脳内では、AppNLGFマウスと比べ、抗酸化分子のグルタチオン※11を合成するための酵素の発現が増加し、炎症性サイトカインが低下していました。AppNLGFマウスでは、脳内に生じたアミロイド斑※12の周囲に活性化したミクログリア※13が集まり炎症が引き起こされ、加えて神経細胞線維の低下を認めました。ところが、Nrf2が活性化したAppNLGF::Keap1FA/FAマウスでは、これらの異常が軽減されていました。さらにAppNLGF::Keap1FA/FAマウスでは、脳内の還元型グルタチオンが増加することで(図1)、酸化ストレスが低下していることもわかりました。
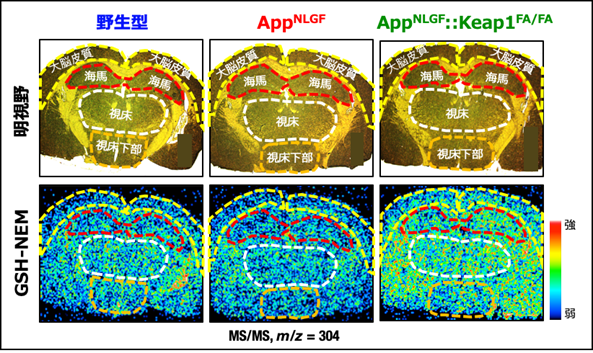
AppNLGFマウスでは、野生型マウスと比較して軽度のGSH低下を示しました。一方、AppNLGF::Keap1FA/FAマウスでは、AppNLGFマウスと比べ広い領域でGSHが増加していました。
Nrf2を活性化する親電子性分子として、ワサビに含まれる6-MSITCが知られています。AppNLGFマウスに6-MSITCを経口投与して、アルツハイマー病への治療効果を検証しました。AppNLGFマウスへの6-MSITC投与は、脳内の活性化型ミクログリア数を低下させました。更に6-MSITCの投与は、AppNLGFマウスにおける認知機能の障害を軽減することが明らかになりました。以上から、生まれつきNrf2が活性化しにくい遺伝要因を持っている場合でも化合物の投与によりNrf2を活性化し、アルツハイマー病の病態を改善できることが分かりました。
今後の展望
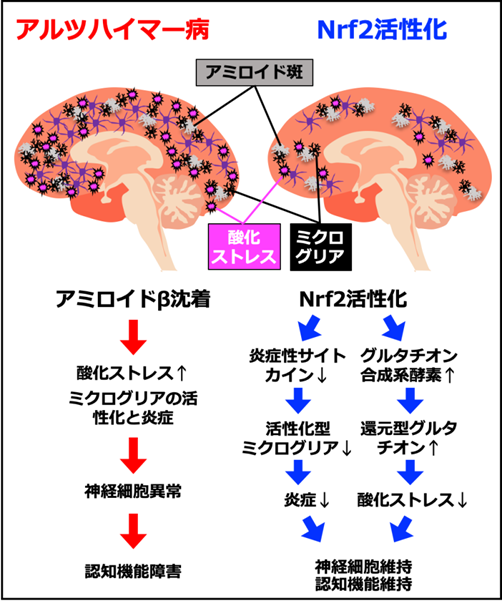
本研究により、Nrf2の活性化が酸化ストレスや炎症を軽減して、アルツハイマー病の病態を改善させることを解明することができました(図2)。今後は、Nrf2を標的とした脳の酸化ストレスや炎症の抑制に基づく、新しい予防法・治療法の開発が可能になるものと期待されます。
用語解説
- ※1 転写因子
- DNAに結合して遺伝子の発現を制御するタンパク質の総称。
- ※2 遺伝子改変
- 遺伝子工学を用いて、人為的に個体の遺伝情報を変化させる手法。
- ※3 アルツハイマー病
- アミロイド斑や神経原線維変化といった病理学的変化をともなう、進行性の神経変性疾患であり、記憶などの認知機能が障害される。
- ※4 酸化ストレス
- 反応性の高い活性酸素種などによるストレス状態であり、DNAやタンパク質が傷害される。
- ※5 多発性硬化症
- 中枢神経系の慢性炎症性脱髄疾患のひとつであり、神経のミエリン鞘と呼ばれる部位が破壊される。再発を繰り返すことが特徴である。
- ※6 慢性腎臓病
- さまざまな原因により、腎機能低下やタンパク尿などが3ヶ月以上持続した状態。末期腎不全への移行や、心血管系疾患の合併などの危険が高い。
- ※7 サイトカイン
- 細胞から分泌されるタンパク質の生理活性物質の総称。細胞間で情報を伝達して、周囲の細胞に影響を与える。
- ※8 Keap1FA/FAマウス
- Keap1の遺伝子の一部を挟み込むように、二つのloxPと呼ばれる配列が挿入された遺伝子改変マウス。一般的に、このような変異を導入したマウスはflox(flanked loxP)マウスと呼ばれ、Creリコンビナーゼという遺伝子組換え酵素を組み合わせて、条件付きで標的遺伝子を欠失させるために利用される。本研究チームでは、loxP配列の挿入部位が異なる、独立した2系統のKeap1Floxマウスである、Keap1FA/FAマウスとKeap1FB/FBマウスを利用している。そのうち、Keap1FA/FAマウスは、Creリコンビナーゼが存在しなくても、全身でKeap1発現が低下している性質を持つことから、全身で穏やかにNrf2が活性化されるモデルとして利用されている。
- ※9 ノックインマウス
- 遺伝子工学手法を用いて、染色体の特定の遺伝子座に変異や挿入を導入した遺伝子改変マウスの総称。
- ※10 AppNLGFマウス
- マウスApp遺伝子座のうち、アミロイドβをコードする領域に、ヒト化変異を導入し、さらに3家系の家族性アルツハイマー病変異に相当する、合計4アミノ酸の非同義変異(Swedish変異KM→NL、Arctic変異E→G、Iberian変異I→F)を導入したノックインマウス。従来のトランスジェニックによるアルツハイマー病モデルマウスと比較して、よりヒト患者に近い病理所見が再現されることが特徴である。詳細は下記を参照。
- ※11 グルタチオン
- システイン、グルタミン酸、グリシンの3種類のアミノ酸から生成される、抗酸化分子。細胞内で、活性酸素の消去や解毒代謝の役割を担う。
- ※12 アミロイド斑
- 異常タンパク質であるアミロイドβが凝集して脳内に蓄積したもので、アルツハイマー病で認められる特徴的な病理所見。
- ※13 ミクログリア
- 脳内のグリア細胞の一つであり、免疫を担当する。アルツハイマー病ではミクログリアが異常に活性化して炎症を引き起こす。
- ※14 質量分析イメージング解析
- 組織から作製した切片上で質量分析を行い、検出された代謝物のシグナルを画像化することで、目的とする代謝物の組織内分布を同定する方法。
論文情報
- 論文題目:
- Nrf2 Suppresses Oxidative Stress and Inflammation in App Knock-in Alzheimer’s Disease Model Mice
「Nrf2はAppノックインアルツハイマー病モデルマウスで酸化ストレスと炎症を抑制する」 - 掲載誌:
- Molecular and Cellular Biology
- DOI:
- 10.1128/MCB.00467-19
- 著者
-
- 東北大学 東北メディカル・メガバンク機構 ゲノム解析部門
宇留野晃、齋藤律水、三枝大輔、山本雅之 - 東北大学 遺伝子実験センター
松丸大輔(現・岐阜薬科大学) - 東北大学大学院 医学系研究科 医化学分野
門口詩織、山本雅之 - 東北大学 加齢医学研究所
領家梨恵、川島隆太 - 理化学研究所 脳神経科学研究センター
斉藤貴志(現・名古屋市立大学)、西道隆臣
- 東北大学 東北メディカル・メガバンク機構 ゲノム解析部門
研究支援先
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の創薬等ライフサイエンス研究支援基盤事業(BINDS)、文部科学省科学研究費補助金、公益財団法人内藤記念科学振興財団、公益財団法人武田科学振興財団の支援を受けて行われました。
お問い合わせ先
研究内容に関すること
東北大学 東北メディカル・メガバンク機構(ToMMo)機構長
東北大学 大学院医学系研究科 医化学分野
教授 山本 雅之(やまもと まさゆき)
電話番号:022-717-8084
Eメール:masiyamamoto"AT"med.tohoku.ac.jp
東北大学 東北メディカル・メガバンク機構(ToMMo)
ゲノム解析部門
准教授 宇留野 晃(うるの あきら)
電話番号:022-273-6210
Eメール:uruno"AT"med.tohoku.ac.jp
報道担当
東北大学 東北メディカル・メガバンク機構(ToMMo)
広報・企画部門
長神 風二(ながみ ふうじ)
電話番号:022-717-7908
ファクス:022-717-7923
Eメール:pr"AT"megabank.tohoku.ac.jp
AMED事業に関すること
日本医療研究開発機構(AMED)
創薬戦略部 医薬品研究課
電話番号:03-6870-2219
Eメール:20-DDLSG-16"AT"amed.go.jp
※Eメールは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和2年1月30日
最終更新日 令和2年1月30日


