成果情報 シェディングされる膜タンパク質を選び出す仕組みを解明―負の電荷を持つアミノ酸がシェディングを阻害する―
成果情報
立命館大学
日本医療研究開発機構
立命館大学生命科学部の白壁恭子教授らの研究グループは、東京医科歯科大学、九州大学、大阪大学との共同研究で、膜たんぱく質の特定の領域のアミノ酸配列が細胞外ドメインシェディング(以下、シェディング)に対する感受性を決めていることを解明いたしました。本研究成果は、学術誌「Journal of Biological Chemistry」で発表し、採択率2%程度であるEditors' Picksにも選出されました。本研究は、国立研究開発法人日本医療研究開発機構の革新的先端研究開発支援事業(AMED-CREST)「生体恒常性維持・変容・破綻機構のネットワーク的理解に基づく最適医療実現のための技術創出」研究開発領域における研究開発課題「細胞間相互作用と臓器代謝ネットワークの破綻による組織線維化の制御機構の解明と医学応用」(研究開発代表者:小川佳宏)の一環で行われました。
本件のポイント
- 細胞膜に埋め込まれた膜タンパク質から細胞外ドメイン*1を切り離す「シェディング」は、切断されるタンパク質だけではなく、それを発現している細胞の機能も変換する影響力の強い分子機構です。
- 本研究では、細胞外ドメインの膜近傍に「負の電荷を持つアミノ酸」を多く含む膜タンパク質はシェディングを免れることを明らかにしました。
- シェディングが関わる炎症性疾患・がん・神経変性疾患といった様々な疾患の治療方法の開発に繋がる可能性があります。
研究分野の背景
細胞膜には様々な機能を持つ膜タンパク質が埋め込まれており、埋め込まれている膜タンパク質の種類によって細胞が果たせる機能も異なります。白壁教授らが研究の対象としているシェディングは、膜タンパク質から細胞外に露出している部分を切り離すという分子機構であり(図1)、細胞表面にある膜タンパク質のレパートリーを変えることで細胞の機能も変えてしまう、強い影響力を持った機構です。また炎症を惹起するサイトカインや細胞増殖を促す増殖因子には、膜タンパク質として作られシェディングされて初めて全身性に作用するものも多く、シェディングは細胞間コミュニケーションの根幹を支えています。シェディングは膜に埋め込まれた切断酵素*2(図1、ハサミ)によって担われますが、この酵素には特定のアミノ酸配列を認識して切断するといった性質はなく、どのようにして限られた膜タンパク質だけがシェディングされるのかはほとんどわかっていませんでした。
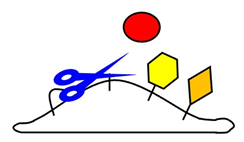
成果の要点
免疫細胞マクロファージが細菌成分を認識して活性化すると、炎症性サイトカインがシェディングされ放出されます。これまでの研究で白壁教授らは、活性化したマクロファージからシェディングされ放出される膜タンパク質をプロテオミクススクリーニングすることで、接着分子ALCAM(activated leukocyte cell adhesion molecule)がシェディングされることを明らかにしていました。本研究では、選択的スプライシングによって生じる2種類のALCAMバリアント*3の解析から、予期しなかったシェディング制御機構を明らかにすることができました。この2つのALCAMバリアントは、シェディングが起こる膜近傍に分子全体の3%にも満たない短いアミノ酸配列(図2上、赤線)が挿入されるか否かで生じますが、挿入されたALCAMはシェディングされず挿入されないALCAMはシェディングされることがわかりました(図2)。この短い配列にはシェディングを阻害する何らかの要素が含まれると考え詳細に解析したところ、配列の半分近くが負の電荷を持つアミノ酸(図2上、緑丸)であること、これらの負の電荷を持つアミノ酸を電荷のないアミノ酸に置換するとシェディングされるようになることがわかりました。白壁教授らは既にCADM1(cell adhesion molecule 1)という別の接着分子について、シェディング切断部位に糖鎖のないCADM1バリアントだけがシェディングされることを報告しています。今回の結果と合わせて考えると、シェディングを担う切断酵素にとって好ましい要素を持つ膜タンパク質が選ばれるのではなく、「阻害要素がない膜タンパク質」が選ばれることでシェディングの特異性が保たれているという、シェディング制御機構の新しい考え方が示唆されます(図3)。
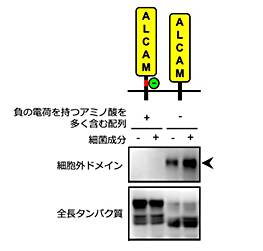
細菌成分を認識すると切断酵素が活性化するが負の電荷を持つアミノ酸があると切断されない
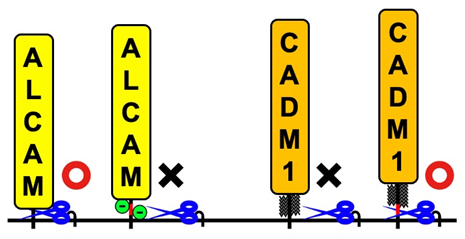
今後の展開と社会へのインパクト
シェディングされる膜タンパク質には炎症の惹起やがんの発症に関わるものもあります。またアルツハイマー型認知症の原因となる膜タンパク質もシェディングされ脳に蓄積することが知られています。シェディングがどういう時に起こって、どういう時に起こらないのか、という制御機構を明らかにすることでこれらの疾患に対する新しい治療方法が構築できるかもしれません。特に、シェディング酵素が負の電荷を嫌うという今回の発見は、何らかの方法で細胞表面に負の電荷をもたらすことでシェディングを抑えられる可能性を示唆しています。現在猛威を奮っている新型コロナウイルスも、全身性の炎症反応の暴走が重篤化の原因と考えられています。シェディングの阻害方法を確立することで様々な疾患の治療方法の構築に貢献できればと考えています。
用語の解説
- *1 細胞外ドメイン
- 脂質でできた細胞膜には様々なタンパク質が埋め込まれており、埋め込まれるタンパク質の種類によって細胞の機能は異なります。膜に埋め込まれたタンパク質のうち細胞外に露出した部分を細胞外ドメインと呼び、細胞と外界とのインターフェイスとしての機能を担っています。
- *2 切断酵素
- シェディングを主に担っているのは、細胞外に活性中心を持つ膜貫通型のタンパク質分解酵素(プロテアーゼ)、ADAM(a disintegrin and metalloprotease)ファミリーです。今回の研究でADAMファミリーには「膜から決まった距離で切断する」という性質があることもわかりました。ADAMファミリーが切断しやすいところにシェディングを阻害する要素があるかどうかで、その膜タンパク質がシェディングされるかどうかが決まると考えています。
- *3 バリアント
- 遺伝子はタンパク質の設計図となる複数の「エキソン」が、タンパク質にならない「イントロン」で挟まれた構造をしています。このエキソンが取捨選択されることを選択的スプライシングと呼び、選択的スプライシングの結果として、一つの遺伝子から作られるエキソンの構成が異なるタンパク質をバリアントと呼びます。
論文情報
- 雑誌名:
- Journal of Biological Chemistry
- 論文名:
- Negatively charged amino acids in the stalk region of membrane proteins reduce ectodomain shedding
- 執筆者名(所属機関名):
- Iwagishi R.1, Tanaka R.1, Seto M.1, Takagi T.1, Norioka N.2, Ueyama T.1, Kawamura T.1, Takagi J.2, Ogawa Y.3,4,5 and Shirakabe K.1,3
(立命館大学1、大阪大学2、東京医科歯科大学3、九州大学4、AMED-CREST5)
白壁教授はR-GIRO、システム視覚科学研究センターの一員です。 - DOI:
- 10.1074/jbc.RA120.013758
本件に関するお問合せ先
立命館大学に関すること
立命館大学広報課 担当:名和
TEL:075-813-8300
E-mail:nawataku“AT”st.ritsumei.ac.jp
AMED 事業に関すること
国立研究開発法人日本医療研究開発機構(AMED) シーズ開発・研究基盤事業部 革新的先端研究開発課
TEL:03-6870-2224
E-mail:kenkyuk-ask“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和2年7月21日
最終更新日 令和2年7月21日


