がん悪性化因子を阻害する新規タンパク質を開発―がん微小環境ネットワークシグナルを標的とした新規治療法への導出に期待―
成果情報
国立大学法人東京医科歯科大学
国立研究開発法人日本医療研究開発機構
ポイント
- 様々な種類のがんの悪性化因子であるトランスフォーミング増殖因子β(TGF-β)※1の全てのアイソフォームを抑制する新規Fc融合タンパク質※2を開発しました。
- 新規Fc融合タンパク質は、口腔がん細胞の悪性化を抑制するのみならず、従来のFc融合タンパク質と比較してより効率的に腫瘍形成を低下させました。
- がん微小環境ネットワーク※3を媒介するTGF-βシグナルを標的とした新規治療法への導出が期待できます。
概要
東京医科歯科大学大学院医歯学総合研究科 硬組織病態生化学分野の渡部徹郎教授、井上カタジナアンナ助教と高橋和樹大学院生等の研究グループは、理化学研究所生命機能科学研究センター創薬タンパク質解析基盤ユニットの白水美香子基盤ユニットリーダーと松本武久研究員、新潟大学大学院医歯学総合研究科薬理学分野の吉松康裕准教授、東京大学大学院医学系研究科分子病理学分野の宮園浩平教授、鯉沼代造准教授、赤津裕一研究員(現 日本化薬株式会社)との共同研究で、がんの悪性化因子であるTGF-βの全てのアイソフォームを抑制する新規Fc融合タンパク質を開発しました。この研究は国立研究開発法人日本医療研究開発機構(AMED)次世代がん医療創生研究事業(P-CREATE)「口腔がんの悪性化機構の解明とそのメカニズムに基づく新規治療標的探索研究」(研究開発代表者:渡部徹郎)、東京医科歯科大学歯学部「最先端口腔科学研究推進プロジェクト」学部長裁量経費(研究開発代表者:高橋和樹)、文部科学省科学研究費補助金等の支援のもとでおこなわれたもので、その研究成果は国際科学誌Journal of Biological Chemistryに、2020年7月6日にオンライン版で発表され、特に優れた論文に与えられる“Editors' Picks”に選ばれました。
研究の背景
近年、がん治療の標的として、がん細胞のみならず、がん微小環境の構成因子である腫瘍血管、がんを悪性化させるがん関連線維芽細胞(CAF)、がん免疫を抑制する制御性T細胞に注目が集まっています。がんの悪性化は、がん微小環境における様々なサイトカイン※4によって調節されています。こうしたサイトカインの中でも、トランスフォーミング増殖因子β(TGF-β)は、がん微小環境に存在する様々な種類の細胞から分泌されて、上皮がん細胞の上皮間葉移行(EMT)※5、腫瘍血管新生※6、CAFの形成、制御性T細胞の分化誘導などを介して腫瘍環境をがんの悪性化へと誘うことが明らかになっており、がんの治療標的として注目されています。TGF-βファミリーにはTGF-β1、-β2、-β3という3つのアイソフォームが存在しますが、その中でTGF-β2の発現は神経膠芽腫(グリオーマ)などの難治がんにおいて高いことが知られています。さらに、研究グループは、最近、腫瘍血管内皮細胞由来のCAFがTGF-β2を分泌することで、がん細胞のEMTを誘導することを報告しました(Yoshimatsu et al., 2020, Cancer Science)。つまり、がん微小環境の構成因子は、ネットワークを形成し、そのネットワークを制御するTGF-β2の治療標的としての重要性が高いことが明らかになりつつあります。
がん促進シグナルを阻害するタンパク質製剤(治療薬)を開発する目的で、がん微小環境において存在するサイトカインの受容体細胞外領域と免疫グロブリンのFc領域を融合させたFc融合タンパク質が開発されています。TGF-βはI型受容体(TβRI)とII型受容体(TβRII)に結合してそのシグナルを伝達しますが(図1A)、TGF-βを標的とした治療薬の候補としてはII型受容体を用いたFc融合タンパク質(TβRII-Fc)が開発されていました(図1B)。TβRII-Fc はTGF-β1とTGF-β3を効率良く阻害できるものの、TGF-β2に対する阻害作用が低いと報告されており、全てのTGF-βアイソフォームを阻害できるFc融合タンパク質の開発が待ち望まれていました。
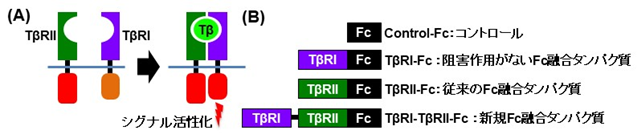
(B) TGF-βシグナルを抑制するために、TβRIIの細胞外領域を免疫グロブリンのFc領域に結合させたFc融合タンパク質(TβRII-Fc)が開発されていた。本研究において、TβRIならびにTβRIIの両者を用いた新規Fc融合タンパク質(TβRI- TβRII-Fc)を開発した。
研究成果の概要
そこで本研究において、TβRIとTβRIIの両方を含むFc融合タンパク質(TβRI-TβRII-Fc)を開発しました(図1B)。これまでの報告通り、TβRIIのみを含むTβRII-FcはTGF-β1とTGF-β3によるシグナルを抑制しましたが、TGF-β2の作用を阻害できないことが確認されました(図2)。しかし、新規Fc融合タンパク質TβRI-TβRII-FcはTGF-βの全てのアイソフォームに結合し、TGF-β2を含む全てのアイソフォームによるシグナル伝達を阻害することが示されました(図2)。さらに研究グループは、頭頸部がん患者においてはTGF-β2が予後不良因子であることを見出しました(図3)。頭頸部がんに含まれる口腔がん由来の口腔扁平上皮がん細胞の悪性化の指標となる上皮間葉移行(EMT)はTGF-βにより誘導されますが(図4)、TβRII-FcはTGF-β1とTGF-β3によるEMT誘導を抑制するにもかかわらず、TGF-β2によるEMT誘導を抑制できないことが示されました(図4)。一方、TβRI-TβRII-FcはTGF-βの全てのアイソフォームによるEMT誘導を抑制できることが明らかになりました。
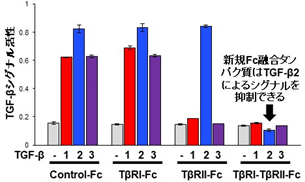
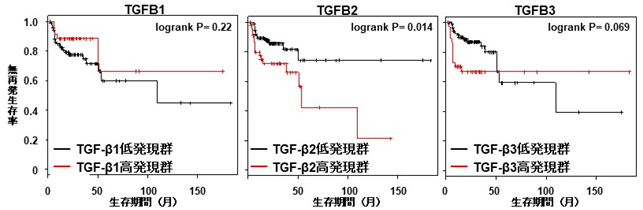
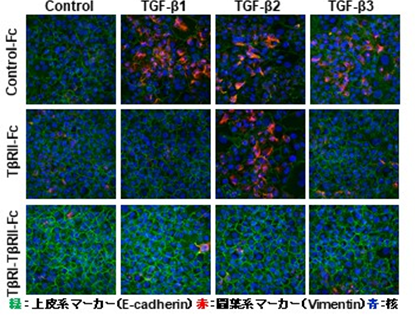
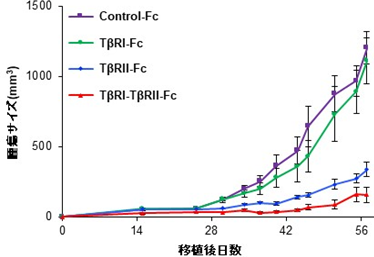
さらに、研究グループはTGF-β2の発現が高い口腔がん細胞の皮下移植モデルを用いて、TβRI-TβRII-FcがTβRII-Fcよりも効率良く腫瘍形成を抑制することを見出しました(図5)。さらに、この作用が腫瘍血管新生の抑制を介することも明らかになりました。以上の結果から、TβRI-TβRII-Fcが、がん微小環境に存在するTGF-βの全てのアイソフォームを標的とした有望な分子標的治療薬となることが示唆されました。
研究成果の意義
がん微小環境中のサイトカインを阻害する分子標的治療薬の候補として、Fc融合タンパク質に注目が集まっています。Fc融合タンパク質などのタンパク質製剤は多くの低分子医薬品よりも血中半減期が長いことが知られており、治療薬としての優位性があることがわかっています。本研究の成果により、TGF-βの全てのアイソフォームを阻害できるFc融合タンパク質が、腫瘍形成をより効率良く抑制できることが示されたため、将来的に口腔がんや神経膠芽腫におけるがん微小環境ネットワークシグナルを標的とした新たながん治療法への導出が期待されます。
用語の説明
- ※1トランスフォーミング増殖因子β(transforming growth factor-β:TGF-β):
- 線維芽細胞の形質転換を促進する因子として同定されたが、現在では多くの種類の細胞に対して増殖抑制作用を有することが明らかになっている。さらに、細胞の分化・運動などにも関与し、個体発生やがんの浸潤・転移など様々な病態生理学的現象において重要な役割を果たすことがわかっている。
- ※2 Fc融合タンパク質:
- 受容体細胞外ドメイン等の機能性タンパク質と抗体イムノグロブリン(IgG)のFc領域を融合させたタンパク質。Fc融合タンパク質の治療薬として、これまでにエタネルセプト(腫瘍壊死因子α受容体の細胞外領域を利用した関節リウマチなどの治療薬)などが承認されている。
- ※3がん微小環境ネットワーク:
- 腫瘍組織に存在する、がん細胞、腫瘍血管やがん関連線維芽細胞(CAF)などの様々な種類の細胞から構成されるネットワークを指す。これらの細胞は、TGF-βなどのサイトカインを分泌することで相互作用し、がんの進展を制御している。
- ※4 サイトカイン:
- 細胞から分泌される低分子のタンパク質で生理活性物質の総称。細胞間相互作用に関与し、周囲の細胞に影響を与える。
- ※5上皮間葉移行(EMT):
- 上皮細胞が間葉系細胞へと分化する過程で、細胞は細胞間接着分子であるE-cadherinやClaudin-1などの発現を消失し、VimentinやSmooth Muscle α–Actin (SMA)などの発現や高い運動・浸潤能などの間葉系細胞の形質を獲得する。EMTは発生過程で見られる生理的な現象だが、組織の線維化やがん転移などの病態の進展にも関与する。
- ※6 腫瘍血管新生:
- 腫瘍が成長するためには栄養と酸素を供給して老廃物・代謝産物を運び出すことが必要であり、腫瘍内への新しい血管の侵入、すなわち血管新生が必要となる。血管新生は血管内皮増殖因子(VEGF)などにより制御され、腫瘍内に侵入した新生血管はがん細胞の遠隔臓器への転移の主要経路となる。
論文情報
- 掲載誌:
- Journal of Biological Chemistry
- 論文タイトル:
- Targeting all transforming growth factor-β isoforms with an Fc chimeric receptor impairs tumor growth and angiogenesis of oral squamous cell cancer
研究者プロフィール
高橋 和樹(タカハシ カズキ)Takahashi Kazuki
東京医科歯科大学大学院医歯学総合研究科
硬組織病態生化学分野 大学院生
- 研究領域
- がん生物学、生化学
渡部 徹郎(ワタベ テツロウ)Watabe Tetsuro
東京医科歯科大学大学院医歯学総合研究科
硬組織病態生化学分野 教授
- 研究領域
- がん生物学、血管生物学、生化学
お問い合わせ先
研究に関すること
東京医科歯科大学大学院医歯学総合研究科
硬組織病態生化学分野
渡部 徹郎(ワタベ テツロウ)
TEL:03-5803-5449 FAX:03-5803-0187
E-mail:t-watabe.bch"AT"tmd.ac.jp
報道に関すること
東京医科歯科大学総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5833 FAX:03-5803-0272
E-mail:kouhou.adm"AT"tmd.ac.jp
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部医薬品研究開発課
TEL:03-6870-2221
E-mail:cancer"AT"amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和2年8月3日
最終更新日 令和2年8月3日


