ヒトiPS細胞から多発性嚢胞腎の病態を再現することに成功―病態解明や新規治療法開発に向け前進―
成果情報
熊本大学
日本医療研究開発機構
ポイント
- 遺伝性腎疾患「常染色体優性多発性嚢胞腎(ADPKD)」の原因遺伝子であるPKD1に変異を導入したヒトiPS細胞※1から腎臓の集合管※2を誘導し、フォルスコリン※3を投与することでADPKDの病態を再現することに成功した。
- ADPKDの増悪因子とされているバゾプレッシン※4についても、PKD1変異を伴う誘導集合管に投与したところ、嚢胞(のうほう)が形成された。
- ADPKD患者から作成されたiPS細胞からも同様に集合管の嚢胞形成を再現することができた。
- ヒトiPS細胞からADPKDの病態を再現することで、病態の解明や新しい治療法の開発につながることが期待される。
要旨
熊本大学発生医学研究所の研究グループ(倉岡将平(大学院生)、西中村隆一教授ら)は、ヒトiPS細胞から常染色体優性多発性嚢胞腎(ADPKD)の病態を試験管内で再現することに成功しました。
ADPKDは両側の腎臓に多発性の嚢胞が発生する病気です。最も頻度の高い遺伝性腎疾患(400-1000人に1人)であり、本邦でも3万人以上の患者がいます。ADPKD患者の半数は60歳までに腎不全へ進行しますが、病気の詳細なメカニズムはいまだに解明されておらず、根本的な治療法も見つかっていません。
ADPKDの腎嚢胞は腎臓内の尿細管※5や集合管から発生しますが、集合管由来の嚢胞が主体と言われています。近年の幹細胞学の進歩によって、ヒトiPS細胞から尿細管由来の嚢胞を誘導することができるようになりましたが、集合管由来の嚢胞はまだ再現されていませんでした。また、尿細管の嚢胞を誘導する手法では、ADPKD患者から作成されたiPS細胞での病態再現ができていませんでした。
今回、倉岡らは、西中村教授らの研究グループが2017年に報告したヒトiPS細胞から集合管を誘導する方法を利用し、フォルスコリンの投与によってヒトiPS細胞から集合管由来の嚢胞を再現することに初めて成功しました。また、原因遺伝子であるPKD1に変異を伴う集合管は、ADPKDの増悪因子であるバゾプレッシン投与に反応して嚢胞を形成することが分かりました。さらに、ADPKD患者由来のiPS細胞でも同様にフォルスコリン投与によって集合管由来の嚢胞を再現できることを証明しました。
本研究は、iPS細胞から集合管を誘導する手法がADPKDに対する新しい疾患モデルになり得ることを示したものです。実際の臨床に近い集合管の嚢胞を解析することで、これまで難しかったメカニズムの解明や新しい治療法の開発につながる可能性があります。また、患者由来iPS細胞からの再現にも成功したことで、個々の症例に対する研究や治療へとつながることも期待されます。
本研究成果は、科学雑誌「Journal of the American Society of Nephrology」オンライン版に2020年8月3日5時00分PM(アメリカ東部時間)【日本時間の2020年8月4日6時00分AM】に掲載されました。
※本研究は、京都大学の堀田秋津教授と長船健二教授らとの共同研究です。
※文部科学省科学研究費補助金及び日本医療研究開発機構再生医療実現拠点ネットワークプログラム(疾患特異的iPS細胞の利活用促進・難病研究加速プログラム)の支援を受けました。
研究の背景
常染色体優性多発性嚢胞腎(ADPKD)は両側の腎臓に多発性の嚢胞が発生する病気です。PKD遺伝子の変異が原因となる遺伝性腎疾患であり、父親と母親から1つずつ受け継ぐ遺伝子のうち、片方(ヘテロ)もしくは両方(ホモ)の遺伝子に変異があると発症します。ADPKDの原因遺伝子としてはPKD1遺伝子とPKD2遺伝子の2つがあり、ADPKD患者の約85%はPKD1遺伝子のヘテロ変異※6、残りの約15%はPKD2遺伝子のヘテロ変異によって引き起こされます。PKD1遺伝子のヘテロ変異を持つ患者の方がより重症な経過をたどり、腎嚢胞の進行によって60歳までに約半数が腎不全となります。ADPKDのメカニズムは、これまで主にマウスを使って研究されてきましたが、PKD1遺伝子のヘテロ変異を持つマウスでは、成体になってもわずかに腎嚢胞がみられる程度でヒトの症状を再現することができていませんでした。
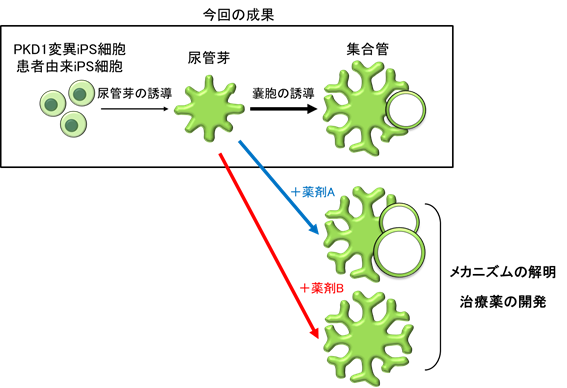
腎臓はネフロン前駆細胞と尿管芽と呼ばれる2つの前駆細胞集団が相互作用することによって発生し、ネフロン前駆細胞は尿中の塩分・水分の再吸収を行う尿細管などへ、尿管芽は尿細管からの尿を集めて更に水分の再吸収を行う集合管へと分化していきます(図1)。ADPKDの嚢胞は腎臓内の尿細管や集合管から発生しますが、集合管から生じた嚢胞が主体と言われています。2014年にヒトiPS細胞からネフロン前駆細胞を経由して尿細管等を誘導する方法が、西中村教授らの研究グループから報告されました。その後、いくつかの研究グループがPKD1遺伝子のホモ変異※7を持ったiPS細胞から尿細管由来の嚢胞を再現することに成功しましたが、集合管由来の嚢胞については再現できていませんでした。また、これまでの方法では、遺伝子変異のない正常なiPS細胞からも嚢胞が形成されてしまい、PKD1遺伝子のヘテロ変異を持つADPKD患者由来のiPS細胞から病態を再現することもできていませんでした。
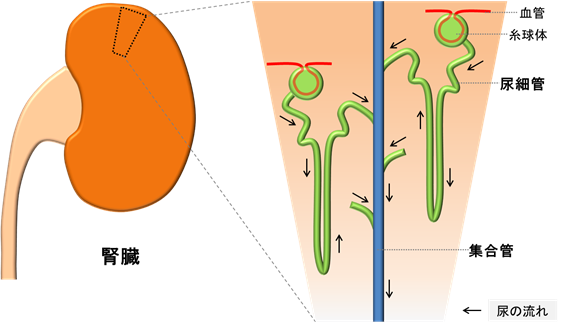
一方、西中村教授らの研究グループは2017年にヒトiPS細胞から尿管芽を経由して集合管を誘導する方法を開発しました。そこで今回は、この方法を利用して、集合管由来の嚢胞を再現することを目的としました。
研究の内容
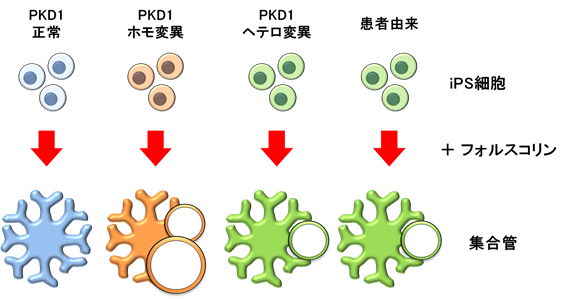
ADPKDの嚢胞を再現するために、CRISPR-Cas9※8という遺伝子編集技術を使って、両方のPKD1遺伝子に変異を持つiPS細胞(ホモ変異iPS細胞)と片方のPKD1遺伝子にのみ変異を持つiPS細胞(ヘテロ変異iPS細胞)を作成しました。まずは、これらのiPS細胞から尿細管へと誘導しました。これにフォルスコリンという薬剤を投与すると、ADPKDの嚢胞を憎悪させる因子が活性化し、これまでの報告と同様に尿細管嚢胞が再現されました。但し遺伝子変異のない尿細管からも軽度の嚢胞が形成されてしまいました。
次に、集合管に誘導してフォルスコリンを投与したところ、PKD1ホモ変異を持つ集合管から嚢胞が形成されました(図2、3)。一方、遺伝子変異のない集合管からは嚢胞が形成されず、フォルスコリンへの反応性が尿細管とは異なるということが分かりました。さらに、集合管に作用するホルモン「バゾプレッシン」の受容体の発現(働き)を確認したところ、集合管でのみ発現していることが分かりました。ADPKDではバゾプレッシンが集合管由来の嚢胞を増悪させることが分かっています。そこで、誘導した集合管および尿細管にバゾプレッシンを投与したところ、低頻度ながらPKD1ホモ変異を伴う集合管だけで嚢胞が形成されることが確認されました(図4)。
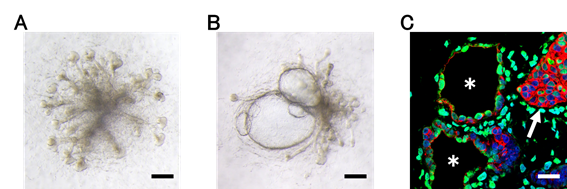
B:PKD1ホモ変異iPS細胞から誘導した集合管にフォルスコリンを投与したところ、多発性に嚢胞が形成されている。(スケールバー:200μm)
C:誘導された集合管(矢印)は集合管のマーカーであるDBA(緑)やサイトケラチン-19(赤)を発現しており、嚢胞上皮でも同様の発現がみられる。
*は嚢胞の内側を示している。(スケールバー:100μm)
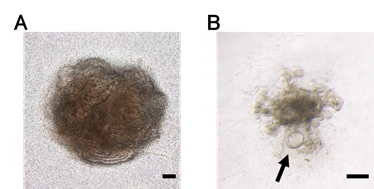
B:PKD1ホモ変異iPS細胞から誘導した集合管にバゾプレッシンを投与したところ、低頻度ながらも嚢胞(矢印)が形成される。(スケールバー:200μm)
また、PKD1ヘテロ変異を伴う集合管からもフォルスコリンを投与することで一部に嚢胞が形成されました(図2)。そこで、PKD1遺伝子にヘテロ変異を持つADPKD患者から作成されたiPS細胞を使って集合管を誘導したところ、同様に嚢胞が形成されることが分かりました(図2)。これは患者由来のiPS細胞から病態を再現することに成功した初めての報告となります。
本研究では、iPS細胞由来の集合管がADPKDを研究するための有用なツールになり得ることを示しました。病態の解明に加えて、新しい治療法の開発への応用が期待されます。
今後の展開
用語解説
- ※1 iPS細胞:
- 皮膚や血液などの体細胞から作られた万能細胞。
- ※2 集合管:
- 多数の尿細管から尿を集めて更に水分を再吸収する腎臓内の部位で、身体の水分バランスをコントロールしている。
- ※3 フォルスコリン:
- ADPKDの嚢胞を増悪させる因子(サイクリックAMP)を活性化する。
- ※4 バゾプレッシン:
- 腎臓の集合管に作用し、水の再吸収を促進することで尿量を減らすタンパク質。抗利尿ホルモンとも呼ばれる。
- ※5 尿細管:
- 血液からろ過された尿から塩分や水分を再吸収する腎臓内の部位。
- ※6 ヘテロ変異:
- 2つある遺伝子のうち、1つが変異体で、もう1つが正常なもの。
- ※7 ホモ変異:
- 2つある遺伝子のうち、2つ共に変異体であるもの。
- ※8 CRISPR-Cas9:
- DNA二本鎖を切断して、ゲノム配列の任意の場所を削除、置換、挿入することができる遺伝子改変技術。
論文情報
- 論文名:
- PKD1-dependent renal cystogenesis in human induced pluripotent stem cell-derived ureteric bud/collecting duct organoids
- 掲載誌:
- Journal of the American Society of Nephrology (2020)
- 著者:
- Shohei Kuraoka, Shunsuke Tanigawa, Atsuhiro Taguchi, Akitsu Hotta,Hitoshi Nakazato, Kenji Osafune, Akio Kobayashi, Ryuichi Nishinakamura
- doi:
- 10.1681/ASN.2020030378
お問い合わせ先
熊本大学発生医学研究所 腎臓発生分野
倉岡将平(くらおかしょうへい)
電話:096-373-6617
E-mail:ga2dazejonan”AT”gmail.com
教授 西中村隆一(にしなかむらりゅういち)
電話:096-373-6615
E-mail:ryuichi”AT”kumamoto-u.ac.jp
事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構 再生・細胞医療・遺伝子治療事業部 再生医療研究開発課
「疾患特異的iPS細胞の利活用促進・難病研究加速プログラム」担当
電話:03-6870-2220
E-mail:saiseinw”AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和2年8月6日
最終更新日 令和2年8月6日


