成果情報 発がん性タンパク質RASの活性を制御する新たな仕組みを発見―RASの活性型割合が細胞内環境下で低下していることをin-cell NMR法により観測―
成果情報
次世代天然物化学技術研究組合
国立研究開発法人理化学研究所生命機能科学研究センター
国立大学法人千葉大学
国立研究開発法人日本医療研究開発機構
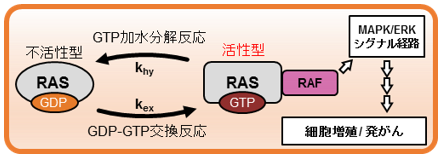
低分子量GTPaseの一種であるRAS1)は、グアノシン2リン酸(GDP)結合型からグアノシン3リン酸(GTP)結合型への変換によって活性化される分子スイッチで、細胞増殖などの細胞内シグナル伝達を制御します。RASを恒常的に活性化させる特定の遺伝子変異はヒトの全がんの30%で検出され、主要ながんの原因となることが知られており、抗がん剤開発の観点からも細胞内におけるRASの活性型割合を調べることは重要です。
次世代天然物化学技術研究組合及び国立研究開発法人理化学研究所生命機能科学研究センターチームリーダー嶋田一夫、および千葉大学大学院薬学研究院西田紀貴教授らの研究グループは、細胞内核磁気共鳴法(in-cell NMR法)2)を用いて、生細胞内におけるRASの活性型(GTP結合型)割合をリアルタイムに観測する手法を開発しました。その結果、細胞内環境下におけるRASの活性型割合は、試験管中(in vitro)で測定した値よりも顕著に低下していることを発見し、RASの活性が分子混雑環境3)や細胞内在性タンパク質によって変調を受けていることを明らかにしました。
今後、RASをはじめとした標的タンパク質に対する阻害剤の有効性を評価する際に、試験管中で再現が困難な細胞内環境下で行うことが可能な本手法が応用されることが期待されます。
研究開発のポイント
- 発がん性タンパク質RAS1)について、in-cell NMR法を用いて生細胞内における活性型割合のリアルタイム観測を行い、細胞内環境下におけるRASの活性型割合が in vitroで測定した値よりも顕著に低下していることを発見した。
- 細胞内におけるRASの活性型割合の低下の原因として、RASのGTP加水分解速度やGDP-GTP交換速度が分子混雑環境3)や細胞内在性タンパク質によって変調を受けるという新たな調節機構を見出した。
- 今後、RASをはじめとした標的タンパク質、またはそのシグナル経路上流のタンパク質に対する阻害剤の有効性を細胞内で直接評価するために本手法が応用されることが期待される。
研究概要
低分子量GTPaseの一種であるRAS1)は、不活性型GDP結合型から活性型のGTP結合型へと変換されることにより下流のシグナル伝達経路を活性化される分子スイッチで、細胞増殖などを制御します(図1)。RASを恒常的に活性化させるG12 G13 Q61(アミノ酸変異)などの特定のコドンへの遺伝子変異は、全てのヒトがんの約30%、特に致死性の高い膵臓がんにおいては90%もの割合で検出されており、RASの異常な活性化は主要ながんの原因であることが知られています。そのため、抗がん剤開発の観点からも細胞内におけるRASの活性度を調べることは重要です。これまでの細胞内のRASの活性度を調べる手法としてはGTP結合型RASと相互作用するタンパク質(RAF)を用いて細胞破砕液内のGTP結合型RASの存在量を定量する手法(プルダウン法)が主流でしたが、この方法ではRASの活性型割合、すなわちGTP/GDP結合型のRASの量比から算出されるRASのGTP結合型割合を生きた細胞内で直接評価し、その経時変化を追跡することはできませんでした。
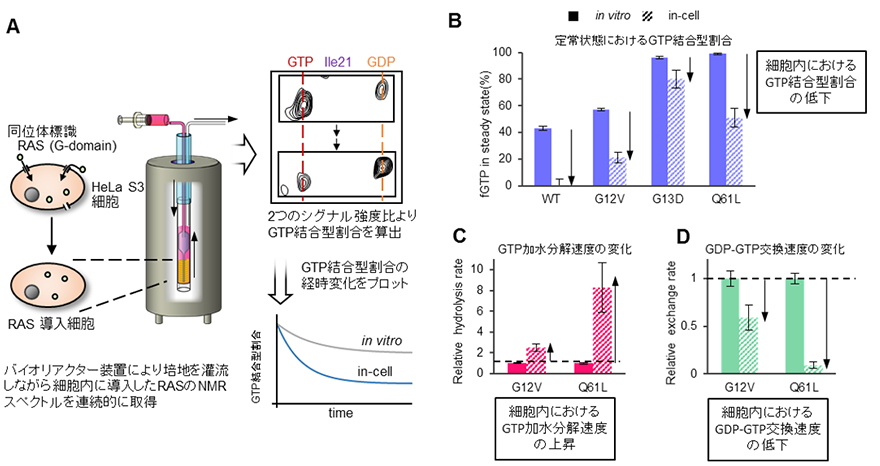
次世代天然物化学技術研究組合および国立研究開発法人理化学研究所生命機能科学研究センターチームリーダー嶋田一夫、および千葉大学大学院薬学研究院西田紀貴教授らの研究グループはin-cell NMR法を用いて、細胞内に導入した同位体標識RASの構造情報を取得し、GTP結合型とGDP結合型間で分離して観測されるシグナルの強度比から生細胞内におけるRASのGTP結合型割合をリアルタイムに観測する手法を開発しました(図2)。そしてこの手法により観測されたGTP結合型割合の経時変化からRASの2つの活性パラメータである細胞内でのRASのGTP加水分解速度(khy)とGDP-GTP交換速度(kex)を算出することに成功しました(図2)。算出された細胞内環境下におけるGTP結合型割合は野生型を含め、すべての発がん性変異体でin vitroよりも顕著に低く、またその要因として細胞内ではin vitroに比べてGTP加水分解速度が上昇する一方で、GDP-GTP交換速度が低下していることを発見しました(図2)。さらに、これらの細胞内におけるRASの活性の変化について、GDP-GTP交換速度については細胞内の分子混雑環境3)下で予測される様々な影響のうち、高い溶液粘性が寄与していることが明らかになりました(図3)。一方で、分子量ごとに分画した細胞の破砕液を用いた実験から30kDa~50kDa付近の分子量を有する細胞内在性タンパク質が発がん性RAS変異体のGTP加水分解速度を上昇させることも明らかになりました(図3)。RASのGTP加水分解速度を上昇させる既知のタンパク質群:RASGAPファミリーはいずれも分子量が50kDa以上かつ発がん性RAS変異体に対しては活性を示さないことが報告されており、今回の結果は異なるメカニズムによってGTP加水分解速度を亢進させる、新規のGAP様タンパク質が細胞内に存在することを示唆しています。
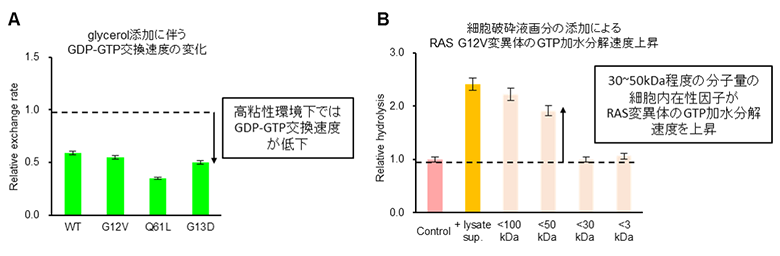
(B)細胞破砕液の分子量画分の添加によるRAS発がん性G12V変異体のGTP加水分解速度(khy)の変化。30~50kDa程度の分子量の細胞内在性因子がRAS変異体のkhyを上昇させることを発見した。
このように本研究で開発した手法を用いることでin vitroでは再構成することが困難な内在性分子や分子混雑環境の存在下にある細胞内タンパク質の状態を直接評価することができるようになりました。今後、RASをはじめとした標的タンパク質、またはそのシグナル経路上流のタンパク質に対する阻害剤の細胞内での有効性を評価するために本手法が応用されることが期待されます。
なお、本研究成果は、2020年8月25日に米国の科学誌Cell Reports誌に掲載されました。
用語解説
- 1)RAS
- RASは約21kDaの分子量を有する低分子量GTPaseであり、グアノシン2リン酸(GDP)が結合した不活性型状態と、グアノシン3リン酸(GTP)が結合した活性化状態とを遷移する分子スイッチである。EGF刺激などによって活性化したGTP結合型のRASはRAFを始めとした様々なエフェクター分子と相互作用し、MAPK経路やAkt経路などの複数のシグナル伝達経路を活性化することで、細胞増殖や細胞運動といった細胞機能を制御している。RASの特定のコドンへの遺伝子変異はRASおよびその下流のシグナル伝達経路の恒常的な活性化による細胞のがん化を引き起こすため、RASの変異は重要ながんの原因の一つであることが知られている。
- 2)細胞内核磁気共鳴(in-cell NMR)法
- 核磁気共鳴法(NMR)は静磁場中の核スピンとラジオ波の相互作用を観測する分光法。同位体標識タンパク質を導入した生細胞をサンプルとしてこのNMR法を適用することで、タンパク質が実際に存在する細胞内環境下でのタンパク質の構造平衡や状態遷移について解析することができる。
- 3)細胞内分子混雑環境(molecular crowding)
- 生細胞中にはタンパク質などの高分子や代謝物が高濃度(300-400mg/mL)で存在し、そのような環境下では分子混雑効果(molecular crowding effect)と呼ばれる高分子間の非特異的な相互作用や各分子の占有体積の減少、および溶液粘性の増大による分子拡散速度の低下などの影響が存在する。これにより一般的なin vitro実験で用いられる希薄溶液に比べてタンパク質の構造や酵素活性が変化することが知られている。
特記事項
※この研究は、日本医療研究開発機構(AMED)「次世代治療・診断実現のための創薬基盤技術開発事業(革新的中分子創薬技術の開発/中分子シミュレーション技術の開発)」、科学研究費助成事業、内藤記念科学財団研究助成および経済産業省の支援によって行われました。
論文情報
- 雑誌名
- Cell Reports(2020年8月25日)
- 論文タイトル
- Real-Time In-Cell NMR Reveals the Intracellular Modulation of GTP-Bound Levels of RAS
- 著者
- Qingci Zhao, Ryu Fujimiya, Satoshi Kubo, Christopher B. Marshall, Mitsuhiko Ikura, Ichio Shimada, Noritaka Nishida
- DOI番号
- 10.1016/j.celrep.2020.108074
お問い合わせ先
内容に関するお問い合わせ
国立研究開発法人理化学研究所 生命機能科学研究センター
チームリーダー 嶋田一夫(しまだいちお)
TEL:045-503-7091 FAX:045-503-9113
E-mail:ichio.shimada”AT”riken.jp
AMEDの事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構
創薬事業部 医薬品研究開発課
次世代治療・診断実現のための創薬基盤技術開発事業担当
TEL:03-6870-2219 FAX:03-6870-2244
E-mail:jisedai-med“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和2年9月11日
最終更新日 令和2年9月11日


