膵がんの「ゲノム医療」に貢献―日本人での原因遺伝子・発症リスク・臨床的特徴の大規模解析―
成果情報
理化学研究所
東京大学医科学研究所
東京大学大学院新領域創成科学研究科
国立がん研究センター
栃木県立がんセンター
日本医療研究開発機構
理化学研究所(理研)生命医科学研究センター基盤技術開発研究チームの水上圭二郎研究員、桃沢幸秀チームリーダー、東京大学医科学研究所人癌病因遺伝子分野の村上善則教授、東京大学大学院新領域創成科学研究科の鎌谷洋一郎教授、国立がん研究センター遺伝子診療部門の吉田輝彦部門長、栃木県立がんセンターの菅野康吉ゲノムセンター長らの国際共同研究グループ※は、世界最大規模となる2万人以上のDNAを解析して、日本人遺伝性膵がんの原因遺伝子・発症リスク・臨床的特徴について明らかにしました。
本研究成果は、日本人の膵がん患者一人一人に合った治療を行う「ゲノム医療」に貢献すると期待できます。
膵がんは、その発生率および死亡率が世界的に増加しており、5年生存率が極めて低いがんです。乳がんや前立腺がんと同様、膵がん患者の数%は一つの病的バリアント[1]疾患の発症に繋がる1カ所のゲノム配列の違い)が発症の原因になると考えられています。しかし、1,000症例以上の膵がん患者において病的バリアントを解析した研究は海外を含め当時2例しか存在せず、ゲノム情報を用いた医療の妨げになっていました。
今回、国際共同研究グループは、11個の膵がん関連遺伝子を含む計27個の遺伝性腫瘍関連遺伝子について、バイオバンク・ジャパン[2]により収集された膵がん患者1,009人を、独自に開発したゲノム解析手法を用いて解析しました。また、大腸がんのゲノム解析において作成した対照群23,780人のデータも併せて解析に使用しました。その結果、205個の病的バリアントを同定し、BRCA1、BRCA2、ATMの3遺伝子が発症に関わっていることや、病的バリアント保有者に見られる臨床的特徴などを明らかにしました。さらに、機械学習[3]による病的バリアント保有者予測を試み、乳がんに比べて膵がんでは予測が困難であることを示しました。今後、本研究で同定されたバリアントデータは国内外の公的データベースに登録、活用される予定です。
本研究は、オンライン科学雑誌『EbioMedicine』(2020年9月24日付:日本時間2020年9月25日)に掲載されました。
- ※国際共同研究グループ
- 理化学研究所
生命医科学研究センター
基盤技術開発研究チーム
チームリーダー 桃沢幸秀(ももざわゆきひで)
研究員 水上圭二郎(みずかみけいじろう)
技師 岩﨑雄介(いわさきゆうすけ)
テクニカルスタッフII 遠藤ミキ子(えんどうみきこ)
がんゲノム研究チーム
チームリーダー 中川英刀(なかがわひでわき)
医科学イノベーションハブ推進プログラム 健康データ数理推論チーム
チームリーダー 川上英良(かわかみえいりょう)(千葉大学大学院医学研究院 人工知能(AI)医学 教授)
国立がん研究センター 中央病院 遺伝子診療部門
部門長 吉田輝彦(よしだてるひこ)
医員 平田真(ひらたまこと)(東京大学 医科学研究所 人癌病因遺伝子分野 非常勤講師)
東京大学 大学院新領域創成科学研究科 メディカル情報生命専攻
複雑形質ゲノム解析分野
教授 鎌谷洋一郎(かまたによういちろう)
クリニカルシークエンス分野
教授 松田浩一(まつだこういち)
栃木県立がんセンター
ゲノムセンター長 菅野康吉(すがのこうきち)(国立がん研究センター中央病院 遺伝子診療部門・非常勤医員)
東京大学 医科学研究所 人癌病因遺伝子分野
教授 村上善則(むらかみよしのり)
Division of Genetics and Population Health, QIMR Berghofer Medical Research Institute(オーストラリア・ブリスベン)
グループリーダー アマンダ・B・スパードル(Amanda B. Spurdle) - 研究支援
- 本研究は、日本医療研究開発機構(AMED)の疾病克服に向けたゲノム医療実現プロジェクトゲノム創薬基盤推進研究事業「乳がん・大腸がん・膵がんに対する適切な薬剤投与を可能にする大規模データ基盤の構築(研究開発代表者:桃沢幸秀)」による支援を受けて行われました。
背景
膵がんは世界的に増加傾向にあるがんの一つであり、特に5年生存率は限局期に発見されても42%と極めて低いという特徴があります注1)。膵がん患者の約10%は家族性膵がん[4]であるといわれており、その発症には遺伝的素因が関与していることが知られています。
遺伝学的検査では、病気の遺伝的素因の一つである病的バリアントを同定します。がん患者を対象に遺伝学的検査を行うことで、適切な薬剤の選択や近親者への早期がんスクリーニングなどが可能になります。例えば近年、BRCA1遺伝子またはBRCA2遺伝子の欠損膵がん患者では、PARP阻害薬[5]の一つであるオラパリブにより無増悪生存期間が延長するという臨床研究が報告されました。そのため、これらの薬剤の適用患者を選択する遺伝学的検査の重要性はますます高まっています。一方で、患者の経済的・心理的負担などの問題などから、検査対象患者を事前に絞り込むことも重要です。しかし、現状では膵がんにおける検査対象患者の有効な絞り込み基準は存在しないため、米国国立包括がんネットワーク(NCCN)のガイドラインでは、膵がんの全ての患者に対して膵がん関連遺伝子を検査することを推奨しています。しかし、膵がんではこれらのガイドラインの根拠となる大規模なゲノム解析の数が乳がんなどに比べて少なく、その対象人種も限られていました。
そこで、国際共同研究グループは、日本人の膵がんについて原因遺伝子や病的バリアントと関連する臨床情報を大規模なサンプルを用いて明らかにし、膵がんのゲノム医療につながるデータを生み出すと同時に、現在のガイドラインの日本人患者への適用性を調べました。
研究手法と成果
国際共同研究グループは、膵がんのNCCNガイドラインにおける検査推奨11遺伝子を含む計27個の遺伝性腫瘍関連遺伝子について、理研が独自に開発したゲノム解析手法を用いて、バイオバンク・ジャパンによって収集された膵がん患者(疾患群)1,009人のDNAを解析しました。その結果、3,610個の遺伝子バリアント[1]を同定しました。さらに、これらの遺伝子バリアント一つ一つを米国臨床遺伝・ゲノム学会(ACMG)が作成したガイドラインおよび国際的データベースClinVar注2)に基づいて病的バリアントか否かを分類したところ、205個の遺伝子バリアントが病的バリアントであると判定されました。
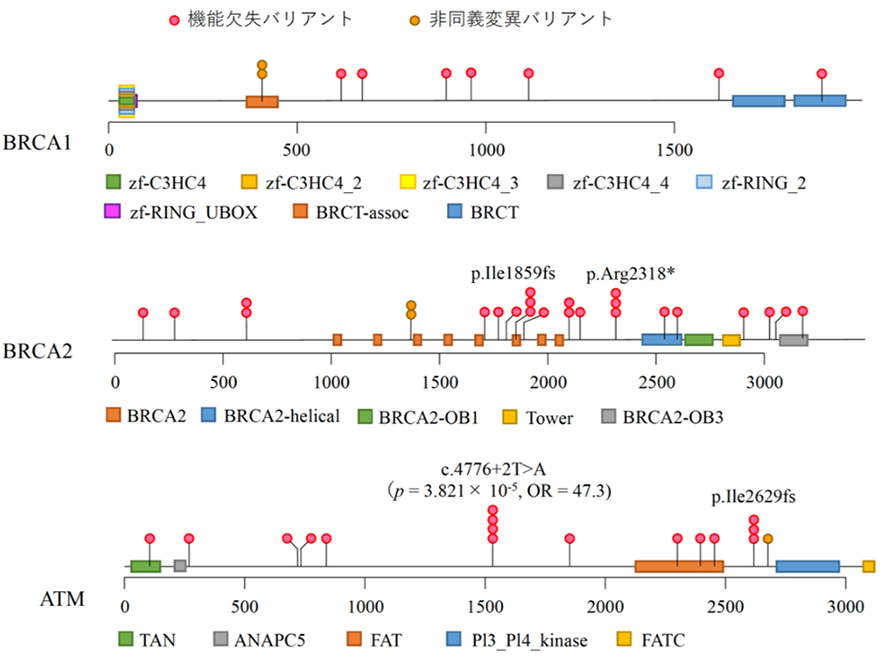
これらの病的バリアントの遺伝子ごとの保有割合を疾患群のデータと大腸がんのゲノム解析において作成した対照群23,780人のデータで比較したところ、BRCA1/2、およびATMの3遺伝子が膵がん発症と関連することが統計学的に明らかとなりました。また、これらの3遺伝子において検出された病的バリアントのうち、79%のバリアントは疾患群において一人しか保有しておりませんでした(図1)。特にATM遺伝子のスプライス部位[6]のバリアントの一つは単独で膵がんと関連することが認められました。膵がん患者の5.1%は、これらの三つの遺伝子に病的バリアントを保有していました。
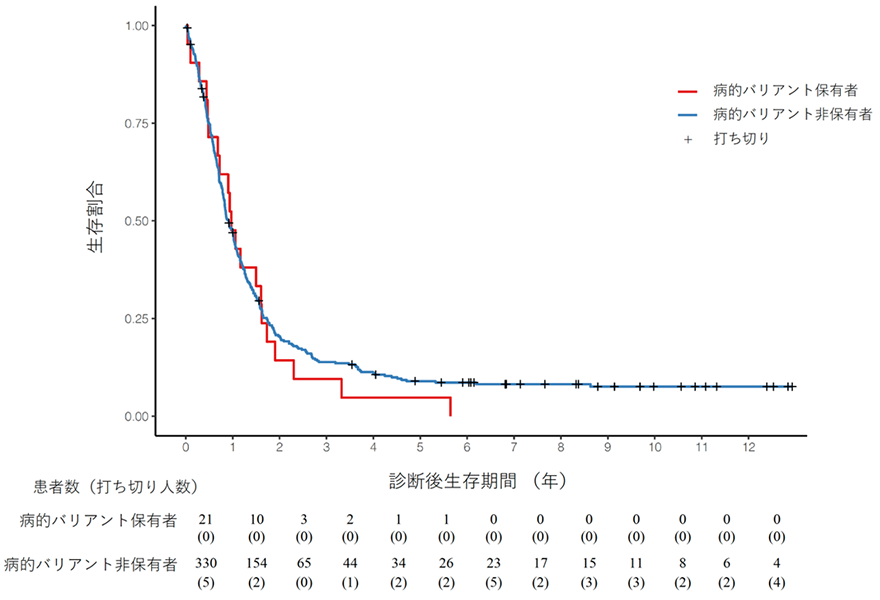
次に、これら3遺伝子における病的バリアント保有者の臨床的な特徴を調べました。まず、病的バリアントの有無と膵がん発症後の生存期間の関係を調べたところ、病的バリアントの有無は生存期間に影響しないことが明らかになりました(図2)。
また、診断年齢との関係を調べたところ、過去の桃沢幸秀チームリーダーらによる乳がんや前立腺がんの研究注3ー4)で見られたような、病的バリアント保有者は発症年齢が下がるといった傾向は認められませんでした。一方で、病的バリアント保有者は、胃がんや卵巣がんの家族歴を高頻度で保有しており、また重度なリンパ管侵襲[7]を示す傾向があることが明らかになりました。
このように、病的バリアント保有者特有の臨床的特徴を明らかにすることは、効率的に遺伝学的検査対象者を絞り込むために重要です。しかし、これまで明らかにされている膵がんの病的バリアント関連臨床情報は、本研究や海外の複数の数百人規模のゲノム研究間で一貫しておらず、依然として遺伝学的検査対象者を有効に絞り込むことは難しいと考えられました。
さらに、本研究では機械学習を用いて臨床情報から病的バリアント有無の予測が可能かを調べました。予測にはバイオバンクジャパンに登録されている臨床情報を使用しました。まず、機械学習を用いた予測が機能するかを調べるために、既にNCCNガイドラインにて遺伝学的検査対象者の選択基準が実用化されている乳がんにおいて、その精度を確認しました。その結果、NCCNガイドラインと同程度の精度で、病的バリアントの有無の予測が可能であることを確認できました(図3A)。
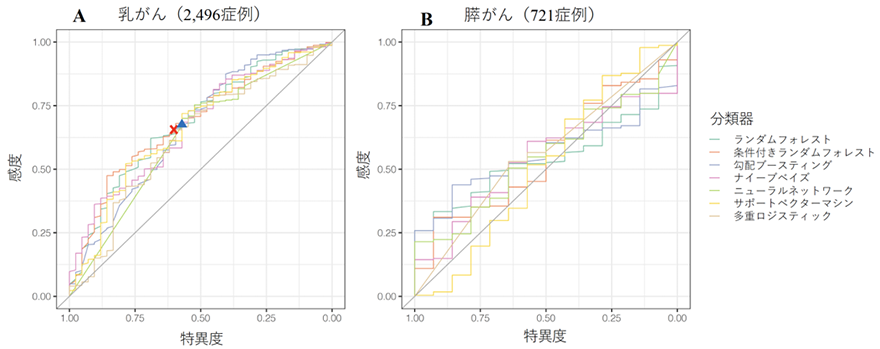
そこで、同様の手法を用いて膵がんにて実施したところ、乳がんとは異なり、予測精度は極めて低いことが明らかとなりました(図3B)。そのため、膵がんでは機械学習を用いても臨床情報に基づく遺伝学的検査対象者の絞り込みは困難であることが示されました。
本研究で得られた各バリアントのサマリー情報は、バイオサイエンスデータベースセンター(NBDC)注5)に登録されます。NBDCの許可を得れば、今後の研究に自由に使用できます。また、各病的バリアントのサマリー情報は、日本の臨床ゲノム情報統合データベース(MGeND)注6)にも登録される予定で、臨床現場における遺伝子バリアントの解釈について重要な情報としての利用が期待されます。
注2)National Center for Biotechnology Information|ClinVar
注3)2018年10月15日理化学研究所プレスリリース「乳がんの「ゲノム医療」に貢献」
注4)2019年7月17日理化学研究所プレスリリース「前立腺がんの「ゲノム医療」に貢献」
注5)バイオサイエンスデータベースセンター - NBDC
注6)MGeND
今後の期待
今回明らかにした遺伝子・疾患発症リスク・臨床情報の大規模データは、今後、膵がんの患者一人一人にあったゲノム医療体制を構築する上で重要な情報になると期待できます。
また、今回複数の手法を用いて膵がん患者での病的バリアント保有者予測の難しさが示されたことから、日本人膵がんにおいても臨床的特徴から遺伝子検査対象者を効果的に選別することは依然困難であると考えられます。一方で、日本人の膵がん患者の3.4%はBRCA1/2遺伝子の病的バリアントを保有していたことから、将来的に一定の膵がん患者においてPARP阻害薬が有効であることが期待でき、遺伝学的検査の重要性は今後一層高まると考えられます。
論文情報
- タイトル
- Genetic characterization of pancreatic cancer patients and prediction of carrier status of germline pathogenic variants in cancer-predisposing genes
- 著者名
- Keijiro Mizukami, Yusuke Iwasaki, Eiryo Kawakami, Makoto Hirata, Yoichiro Kamatani, Koichi Matsuda, Mikiko Endo, Kokichi Sugano, Teruhiko Yoshida, Yoshinori Murakami, Hidewaki Nakagawa, Amanda B. Spurdle, Yukihide Momozawa,
- 雑誌
- EBioMedicine
- DOI
- 10.1016/j.ebiom.2020.103033
補足説明
- [1]遺伝子バリアント、病的バリアント
- ヒトのDNA配列は30億の塩基対からなるが、その配列の個人間の違いを遺伝子バリアントという。そのうち、疾患発症の原因となるものを病的バリアントと呼ぶ。
- [2]バイオバンク・ジャパン
- 日本人集団27万人を対象とした、世界最大級の疾患バイオバンク。オーダーメイド医療の実現プログラムを通じて実施され、ゲノムDNAや血清サンプルを臨床情報と共に収集し、研究者へ分譲を行っている。2003年から東京大学医科学研究所内に設置されている。
- [3]機械学習
- コンピュータが大量のデータから規則性や判断基準を学習し、それに基づいて未知のデータを分類する技術。
- [4]家族性膵がん
- 膵がんに罹患した第一度近親者(親子、兄弟姉妹)を2人以上有する膵がんのこと。
- [5]PARP阻害剤
- DNAの相同組換え修復機構が機能していないがん細胞に、特異的に細胞死を誘導する新しい分子標的薬のこと。
- [6]スプライス部位
- 遺伝子の転写産物においてイントロンが除去されエキソン同士が結合する反応をRNAスプライシングと呼ぶが、この反応に必要で塩基配列の保存性が高い遺伝子上の領域のこと。
- [7]リンパ管侵襲
- 病理検査にて、切除したがん組織の中のリンパ管にがん細胞が入り込んでいる状態をいう。
発表者・機関窓口
理化学研究所(理研)生命医科学研究センター基盤技術開発研究チーム
研究員 水上圭二郎(みずかみけいじろう)
チームリーダー 桃沢幸秀(ももざわゆきひで)
東京大学医科学研究所 人癌病因遺伝子分野
教授 村上善則(むらかみよしのり)
TEL:03-5449-5260
E-mail:ymurakam“AT”ims.u-tokyo.ac.jp
東京大学大学院新領域創成科学研究科
メディカル情報生命専攻 複雑形質ゲノム解析分野
教授 鎌谷洋一郎(かまたによういちろう)
(理研 生命医科学研究センター ゲノム解析応用研究チーム 客員主管研究員)
TEL:03-5449-5286
E-mail:kamatani.yoichiro“AT”edu.k.u-tokyo.ac.jp
国立がん研究センター遺伝子診療部門
部門長 吉田輝彦(よしだてるひこ)
栃木県立がんセンター
ゲノムセンター長 菅野康吉(すがのこうきち)
機関窓口
理化学研究所 広報室 報道担当
E-mail:ex-press“AT”riken.jp
*今般の新型コロナウイルス感染症対策として、理化学研究所では在宅勤務を実施しておりますので、メールにてお問い合わせ願います。
東京大学医科学研究所 国際学術連携室(広報)
E-mail:koho“AT”ims.u-tokyo.ac.jp
東京大学大学院新領域創成科学研究科 広報室
TEL:04-7136-5450
E-mail:press“AT”k.u-tokyo.ac.jp
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
〒104-0045 東京都中央区築地5-1-1
TEL:03-3542-2511(代表) FAX:03-3542-2545
E-mail:ncc-admin“AT”ncc.go.jp
AMED事業に関するお問い合わせ
日本医療研究開発機構(AMED)
ゲノム・データ基盤事業部 ゲノム医療基盤研究開発課
ゲノム創薬基盤推進研究事業事務局
〒100-0004 東京都千代田区大手町一丁目7番1号 読売新聞ビル22F
TEL:03-6870-2228 FAX:03-6870-2244
E-mail:genomic-medicine“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和2年12月3日
最終更新日 令和2年12月3日


