成果情報 アスコルビン酸噴霧で植物の細胞死が抑制される―細胞でのタンパク質の生産性が向上―
成果情報
国立大学法人筑波大学
国立大学法人東北大学
国立研究開発法人日本医療研究開発機構
医薬品などに用いられる有用なタンパク質を生産する手段の一つに、植物を宿主として利用するものがあります。しかし、目的とするタンパク質の種類によっては、植物の体内でタンパク質を発現させる際に、壊死(細胞死)が起こり、収量が大きく低下してしまうという問題があります。この壊死は、小胞体ストレスを受けると放出される活性酸素によって引き起こされると考えられていますが、これを抑制するための有効な方法は、未だに見つかっていませんでした。
そこで本研究グループは、植物において、活性酸素が及ぼす影響の緩和に着目し、抗酸化物質である高濃度アスコルビン酸を噴霧することにより、壊死を抑制し、タンパク質の生産性向上、および、これまでほとんど発現していなかったタンパク質の発現に成功しました。また、高濃度アスコルビン酸の噴霧は、発現するタンパク質の活性に影響を及ぼさないことも分かりました。
高濃度アスコルビン酸を噴霧して壊死を抑制するという方法は、極めて汎用的に適用できるものと考えられます。本研究成果は、植物細胞を用いたタンパク質発現システムのスタンダードとなり得る基盤技術として重要であり、特許協力条約(PCT)に基づく国際特許を出願済みです。この手法により、様々な種類のタンパク質を大量に作製できることが可能になると期待されます。
研究代表者
筑波大学生命環境系
三浦謙治教授
東北大学大学院医学系研究科
加藤幸成教授
研究の背景
医薬品などに用いる有用タンパク質の大量作製技術としては、大腸菌や酵母、動物細胞などを宿主として用いるものが知られていますが、近年、植物を利用する方法が、コストなどの点から注目されています。中でも、アグロインフィルトレーション注1)を用いた、植物におけるタンパク質生産では、大腸菌などを用いたタンパク質発現システムに引けを取らない収量を得ることができます。本研究グループが以前に開発した「つくばシステム」(URL:https://sites.google.com/view/tsukubapmcb/research/tsukuba-system)と呼ばれるタンパク質大量発現システムもその一つです。しかしながら、植物によるタンパク質発現システムでは、発現させるタンパク質によっては植物の壊死注2)(細胞死)が引き起こされ、タンパク質が分解されて収量が大幅に低下するという問題がありました。この壊死は、小胞体ストレス注3)により発生する大量の活性酸素によるものと考えられていますが、これを抑制する根本的な方法は明らかにされていませんでした。壊死を抑制することができれば、タンパク質の収量を向上させることができると期待されます。
研究内容と成果
本研究グループは、細胞死を抑制する方法として、活性酸素を除去するための抗酸化物質に着目しました。これまでに、つくばシステムにおいて、ヒトhCul1(ユビキチンE3リガーゼ複合体構成タンパク質)およびhFbxw7(F-boxタンパク質)を、ナス科のモデル植物であるベンサミアナタバコを用いて発現させると、壊死が引き起こされ、ほとんどタンパク質が発現できないことが分かっていました。そこで、抗酸化物質として入手が容易なアスコルビン酸ナトリウムを噴霧し、活性酸素の影響の緩和を試みました。低濃度のアスコルビン酸では効果は見られませんでしたが、100mM以上の高濃度アスコルビン酸を用いたところ、壊死を抑制することに成功しました(図1)。このとき、hCul1タンパク質の発現量が大幅に上昇しました(図2左)。このことから、高濃度アスコルビン酸噴霧により、壊死を抑制し、タンパク質の発現量が向上できることが明らかとなりました。

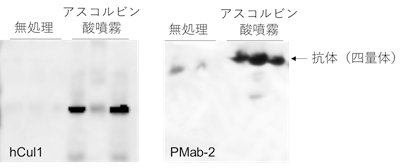
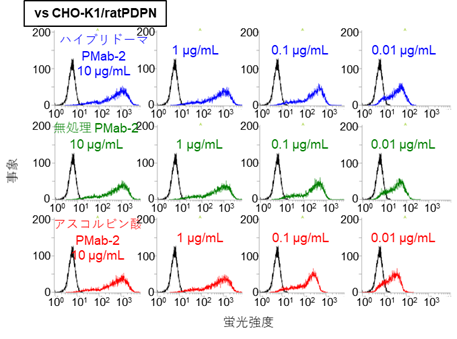
次に、高濃度アスコルビン酸噴霧が、タンパク質複合体形成に影響を及ぼすかを調べるため、PMab-2抗体注4)の遺伝子を発現させたベンサミアナタバコに、アスコルビン酸を噴霧しました。抗体はヘテロ四量体(抗体の一般的な構造である、四つの異なるタンパク質の複合体)を形成しますが、アスコルビン酸噴霧により、この形成が促進されました(図2右)。こうして形成されたタンパク質の機能性を確かめるため、アスコルビン酸を噴霧した植物からPMab-2抗体を精製し、抗原注5)との結合を調べたところ、ハイブリドーマ細胞注6)由来PMab-2抗体と同様の抗体活性を示しました(図3)。このことから、高濃度アスコルビン酸の噴霧により発現量が上昇したタンパク質は、その活性も維持されることが明らかとなりました。
今後の展開
本方法により、植物細胞を用いたタンパク質生産において、これまで、壊死のために収量が低かったタンパク質も、収量を改善できる可能性があります。また、作製が難しいタンパク質も含め、生産できるタンパク質の種類が広がると考えられます。アスコルビン酸の噴霧という簡便な方法は、今回用いたつくばシステム以外のタンパク質大量発現システムにおいても利用可能です。また、特殊な施設が不要という利点もあり、医療、食品、工業的に重要なタンパク質を生産するための重要な基盤技術になるものと期待されます。
用語解説
- 注1)アグロインフィルトレーション
- アグロバクテリウムと呼ばれる、植物に対する病原性をもつ細菌を、植物体の一部分に感染させる方法。アグロバクテリウムは植物細胞に感染してT-DNAを植物細胞核内へ送り込むことができるため、当該遺伝子の発現を調べることが可能である。
- 注2)壊死
- 生体の一部の組織や細胞が死んでいく様、または死んだ細胞の痕跡のこと。
- 注3)小胞体ストレス
- 細胞内の小胞体において折りたたみ不全のタンパク質が蓄積した状態。小胞体ストレスが生じると、細胞は状態を改善するために、ストレス応答(UPR, unfolded protein response)によって、折りたたみ不全タンパク質を除去するようにはたらく。ただし、過度あるいは持続的な小胞体ストレスは、UPRでは対処しきれず、最終的に細胞死が引き起こされる。
- 注4)抗体
- 免疫グロブリンというタンパク質。一般的な抗体は、2本の重鎖(H鎖:分子量の重い分子鎖)と2本の軽鎖(L鎖:分子量の軽い分子鎖)から成るタンパク質の複合体であるヘテロ四量体(異なる4つのタンパク質で形成される複合体)を形成する。
- 注5)抗原
- 抗体を誘導する物質。抗体に特異的に結合する。
- 注6)ハイブリドーマ細胞
- 複数の細胞が融合してできた融合細胞のこと。本研究では、モノクローナル抗体(PMab-2)を産生する、B細胞と骨髄腫がん細胞(ミエローマ)の融合細胞を示す。
研究資金
本研究は、科学研究費補助金(19H04637、20K21302)、日本科学技術振興機構(JST)・産学共創プラットフォーム共同研究推進プログラム(OPERA、JPMJOP1851)、日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業(BINDS;JP19am0101078)、先端的バイオ創薬等基盤技術開発事業(JP19am0401013)、T-PIRC遺伝子実験センター「形質転換植物デザイン研究拠点」の一部によって実施されました。
掲載論文
- 題名
- Prevention of necrosis caused by transient expression in Nicotiana benthamiana by application of ascorbic acid
- (アスコルビン酸投与により、ベンサミアナタバコにおける一過的タンパク質発現によって引きおこされる壊死の抑制が可能に)
- 著者名
- Shohei Nosaki, Mika K. Kaneko, Fuminori Tsukuta, Hideki Yoshida, Yukinari Kato, Kenji Miura
- 掲載誌
- Plant Physiology
- 掲載日
- 2021年2月26日
- DOI
- 10.1093/plphys/kiab102
プレスリリース
お問い合わせ先
研究に関すること
三浦謙治(みうらけんじ)
筑波大学生命環境系 教授/つくば機能植物イノベーション研究センター 副センター長
TEL:029-853-6401
E-mail:miura.kenji.ga“AT”u.tsukuba.ac.jp
三浦謙治(ミウラケンジ;Miura, Kenji)|TRIOS
加藤幸成(かとうゆきなり)
東北大学大学院医学系研究科抗体創薬研究分野/未来科学技術共同研究センター 教授
E-mail:yukinarikato“AT”med.tohoku.ac.jp
取材・報道に関すること
筑波大学広報室
TEL:029-853-2040
E-mail:kohositu“AT”un.tsukuba.ac.jp
東北大学大学院医学系研究科・医学部広報室
TEL:022-717-7891
E-mail:pr-office“AT”med.tohoku.ac.jp
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
創薬等ライフサイエンス研究支援基盤事業(BINDS)
創薬事業部 医薬品研究開発課
TEL:03-6870-2219
E-mail:20-ddlsg-16“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年3月4日
最終更新日 令和3年3月4日


