成果情報 世界初、非ウイルス遺伝子改変GMR CAR-T細胞を用いた医師主導治験(ヒト初回投与試験)開始
成果情報
信州大学
日本医療研究開発機構
ポイント
- 信州大学発、piggyBac遺伝子改変CAR-T細胞の医師主導治験
- 世界初のGM-CSF受容体(CD116/CD131複合体)を標的とするCAR-T細胞
- 日本初のリガンド型CAR-T細胞
- 日本初の急性骨髄性白血病を対象とするCAR-T細胞治験
- 世界初の若年性骨髄単球性白血病を対象とするCAR-T細胞治験
- 日本のCAR-T細胞開発を加速させる、シーズ開発から治験製品製造・品質管理、FIH医師主導治験までを単一アカデミアで、低コストで行うオールイン・ワン型創薬モデル
発表概要
信州大学医学部附属病院(以下、信大病院)小児科 中沢洋三教授らの研究グループは、世界初のGM-CSF受容体(CD116/CD131複合体、以下、GMR)を標的とするキメラ抗原受容体(CAR)-T細胞の臨床開発を進めています。このたび、急性骨髄性白血病および若年性骨髄単球性白血病(CD116陽性骨髄系腫瘍)の患者を対象として、GMR CAR-T細胞療法の安全性と有効性の評価を目的とした第I/II相医師主導治験(ヒト初回投与試験)を開始します。
CAR-T細胞療法とは、がん患者の免疫細胞(T細胞)を体外に取り出し、この免疫細胞にがん細胞に対する特異性と攻撃力を高める遺伝子を組み込んで患者体内に戻す治療法です。がん免疫療法と遺伝子治療の長所を組み合わせているのが特徴で、腫瘍免疫回避機構を克服する最も有望な次世代がん治療法と考えられています。
血液腫瘍の一つであるリンパ系腫瘍を対象とするCAR-T細胞は、2019年以降3製品が国内で承認されています。一方、骨髄系腫瘍を対象とするCAR-T細胞は、2010年頃から欧米・中国を中心に開発が進められていますが、いまだ臨床応用には至っていません。
従来、CAR-T細胞はウイルスベクターを用いた方法で作製されてきましたが、中沢教授らは、piggyBacトランスポゾン(酵素)法と電気穿孔法を組み合わせることによって、ウイルスベクターを使わずに効率的・安価・安全にCAR-T細胞を作製できる革新的な手法を確立しました。2016年には世界で初めて、若年性骨髄単球性白血病を対象とする、GM-CSF受容体(CD116/CD131複合体)を標的とするGMR CAR-T細胞の開発に成功しました。2017年からは、日本医療研究開発機構(AMED)の支援のもと、骨髄系腫瘍(急性骨髄性白血病、若年性骨髄単球性白血病など)を対象とするGMR AR-T細胞の医師主導治験の準備を進めてきました。2021年3月22日付けで治験届が受理されましたので、医師主導治験を開始します。
対象疾患
急性骨髄性白血病(以下、AML)は、骨髄球系造血細胞のがん化によって生じる骨髄系腫瘍で、小児から高齢者まで幅広く発症がみられます(人口10万人あたり約4人)。治療の中心は薬物治療ですが、薬物治療を行っても10–20%に治療不応、40-50%に再発がみられます。再発・治療不応患者に対しては同種造血幹細胞移植が施行されますが、非寛解期での移植や2回目以降の移植における予後は不良です。そのため、再発・治療不応性AMLを完全寛解に導く新しい治療薬の開発が期待されています。
若年性骨髄単球性白血病(以下、JMML)は、造血幹細胞のがん化により単球と骨髄球系造血細胞が異常増殖する骨髄系腫瘍で、乳幼児に発症します(人口100万人あたり1~2人)。薬物治療に抵抗性で、根治的な治療法は同種造血幹細胞移植のみですが、全例が非寛解期での移植となるため再発率が高く、小児白血病の中では最も予後不良な疾患です。そのため、移植前に白血病細胞を最大限に減少させる有効な治療薬の開発が期待されています。
非ウイルス遺伝子改変GMR CAR-T細胞
キメラ抗原受容体(CAR)とは、がん細胞上の標的抗原と特異的に結合する領域とT細胞に活性化シグナルを伝達する領域を併せ持つ人工受容体の総称です。遺伝子組換え技術を用いてCARを発現させたT細胞はCAR-T細胞と呼ばれます。がん患者(またはドナー)のT細胞を体外に取り出してCAR-T細胞を作製し、患者の体内に戻すex vivo遺伝子治療法をCAR-T細胞療法と呼びます。がん免疫療法と遺伝子治療の長所を組み合わせているのが特徴で、最も有望な次世代がん治療法の1つと考えられています。
リンパ系腫瘍(急性リンパ性白血病・悪性リンパ腫)を対象とする、CD19抗原を標的としたCAR-T細胞の治療効果は非常に高く、これまで3製品が国内で承認されています。骨髄系腫瘍(主に急性骨髄性白血病)に対しても、2010年頃から欧米と中国を中心にCAR-T細胞の開発が行われていて、これまでに10種類以上のCAR-T細胞の臨床試験が行われていますが、いまだ有望なCAR-T細胞は見つかっていません。
中沢教授らは、2007年からpiggyBacトランスポゾン(アオムシ由来遺伝子転位酵素)法と電気穿孔法を組み合わせた革新的な手法で、ウイルスベクターを使わずにCAR-T細胞を作製する技術を開発してきました(図1、Nakazawa Y, et al. J Immunother 2009; 他、国際論文14編)。このpiggyBac法は“Faster, Cheaper, Safer, T cell engineering”と米国専門誌に紹介され、効率的・安価・安全にCAR-T細胞を臨床製造できる技術として国際的に高く評価されています。さらに最近の研究で、piggyBac法で作製したCAR-T細胞は機能面においても優れていることを明らかにしています。
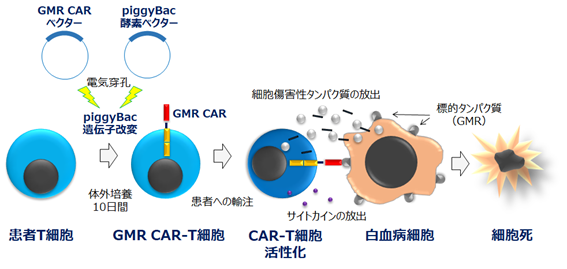
GM-CSF受容体(CD116/CD131複合体、以下、GMR)は、骨髄球系細胞の分化・増殖を刺激する顆粒球・マクロファージコロニー刺激因子(GM-CSF)の受容体で、CD116蛋白とCD131蛋白から構成されています。GMRは急性骨髄性白血病(AML)の63-83%と若年性骨髄単球性白血病(JMML)の100%に発現することがこれまでの研究からわかっています。
GMR CAR-T細胞は、このGMRを標的とする世界で初めてのCAR-T細胞で(図1)、CARの設計において標的抗原結合領域に、従来の抗体ではなく、リガンド(受容体と結合する蛋白)であるGM-CSFを用いていることが大きな特徴です。2011年から研究に着手し、2016年にはJMML患者由来の白血病細胞の増殖を強力に抑制できることを報告しています(Nakazawa Y, et al. J Hematol Oncol 2016)。
2017年からは、日本医療研究開発機構(AMED)革新的がん医療実用化研究事業の中で、効果と安全性を高めるための改変(再設計)を行い、改変GMR CAR-T細胞が先行開発品よりもAML細胞を試験管内で強く殺傷すること、ヒトAML細胞を移植した免疫不全マウスの生存期間を大幅に延長させることを示しました。この改変GMR CAR-T細胞を開発候補品と決定し、これまで非臨床試験、治験プロトコールの作成、信大病院における治験薬GMP体制の構築などの医師主導治験の準備を進めてきました。このたび、2021年3月22日付けで治験届が受理されましたので、信大病院において医師主導治験を開始します。
治験製品の製造・品質管理
治験製品は、非ウイルスベクター製法の利点を活かして、適切に管理された信大病院先端細胞治療センター・細胞調製室(CPC)で製造し、品質試験を信州大学遺伝子・細胞治療研究開発センター・品質検査室(QC Lab)で実施します(図2、一部外部委託)。シーズ開発から、治験製品の製造・品質管理、FIH(ヒト初回投与)医師主導治験までを単一アカデミアで、低コストで行うオールイン・ワン型創薬は、今後の日本のCAR-T細胞開発を加速させる新しいモデルになると考えています。

| 治験課題名 | CD116陽性骨髄系腫瘍に対する非ウイルス遺伝子改変キメラ抗原受容体T細胞療法 |
|---|---|
| 治験の相 | 第Ⅰ/Ⅱ相 |
| 治験の目的 | CD116陽性骨髄系腫瘍患者を対象として、非ウイルス遺伝子改変キメラ抗原受容体T(GMR CAR-T)細胞を単回静脈内投与したときの安全性、有効性及び薬物動態を検討する。 |
| 対象 | 本治験の参加に本人もしくは代諾者から文書による同意の得られたCD116陽性骨髄系腫瘍(急性骨髄性白血病及び若年性骨髄単球性白血病)患者のうち、寛解導入不能例もしくは移植後再発例を対象とする。 |
| 治験デザイン | 単施設非盲検漸増試験 |
| 投与量及び投与方法 |
GMR CAR-T細胞(CAR陽性細胞)の投与は,18歳以上のCD116陽性骨髄系腫瘍患者に対する3×105 cells/kg静脈内投与(コホート1)より開始し,安全性に問題ないと判断された場合に以下に示す次コホート(小児及び高用量)へ移行する。なお、各コホートは3例ずつの実施とする。
|
今後期待される展開
この医師主導治験でGMR CAR-T細胞の安全性が確認され、有効性も期待できた場合は、1日でも早く1人でも多くの患者さんに届けられるように、企業治験へ橋渡します。
研究費
- 2017年度~2019年度 日本医療研究開発機構(AMED)革新的がん医療実用化事業「CD116陽性骨髄系腫瘍を標的とした非ウイルス遺伝子改変キメラ抗原受容体T細胞の非臨床試験」(研究開発代表者:中沢 洋三)
- 2020年度~2022年度 日本医療研究開発機構(AMED)革新的がん医療実用化事業「CD116陽性急性骨髄性白血病および若年性骨髄単球性白血病を対象とする非ウイルス遺伝子改変GMR CAR-T細胞のFIH医師主導治験」(研究開発代表者:中沢 洋三)
- 2018年度~2023年度 日本医療研究開発機構(AMED)再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(遺伝子治療製造技術開発) 「遺伝子・細胞治療の実用化を促進するための霊長類モデルを用いた安全性評価系の基盤整備」(研究開発代表者:中沢 洋三)
お問い合せ先
治験に関すること
信州大学医学部附属病院 臨床研究支援センター
e-mail:gmr_cart-cr“AT”shinshu-u.ac.jp
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
再生・細胞医療・遺伝子治療事業部 遺伝子治療研究開発課
革新的がん医療実用化研究事業事務局
E-mail:cancer“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和3年4月7日
最終更新日 令和3年4月7日


