成果情報 肺炎球菌が細胞内にマンガンイオンを取り込むしくみ―膜輸送体PsaBCの立体構造の解明―
成果情報
京都大学
日本医療研究開発機構
概要
岩田想京都大学大学院医学研究科教授、野村紀通同准教授は、Megan Maherオーストラリア・メルボルン大学准教授、Christopher McDevitt同准教授らと共同で、肺炎球菌が病原性をもつ上で重要な働きをする膜輸送体タンパク質PsaBCの精密立体構造を解明しました。
肺炎球菌Streptococcus pneumoniaeは、世界中で毎年100万人以上が死亡する感染症(細菌性肺炎)の主要な病原菌です。肺炎球菌はヒトの鼻咽頭に無症状で定着しますが、やがて時間が経つと様々な組織や臓器に移動して感染症を引き起こします。肺炎球菌にとって、ヒト体内での増殖や病原性発現に不可欠な金属の一つがマンガン(Mn)です。肺炎球菌は宿主であるヒト体内からMn2+イオンを奪って細胞内に取り込みます。PsaBCはMn2+イオンの「取り込み口」として働く膜タンパク質です。
本研究では、PsaBCがMn2+イオンを細胞内に輸送するメカニズムを分子レベルで理解するために、PsaBCの精密立体構造を可視化しました。今回得られた立体構造情報は、Mn2+イオンの「補給路」を断ち、取り込みを制限することによって肺炎球菌の増殖を抑えるような新たな化合物を開発する基盤になると考えられます。
本研究成果は2021年8月7日に、国際学術誌「Science Advances」に掲載されました。
背景
肺炎球菌Streptococcus pneumoniaeは、世界中で毎年100万人以上の死亡原因となる感染症の病原菌です。肺炎球菌は、細菌性肺炎の主な原因であると同時に、髄膜炎、敗血症、中耳炎の原因ともなり、多数の5歳未満小児がこの病原菌の感染により死亡します。肺炎球菌はヒトの鼻咽頭に無症状で定着しますが、やがて時間が経つと様々な組織や臓器に移動して感染症を引き起こします。肺炎球菌にとって、ヒト体内での増殖や病原性発現に不可欠な金属の一つがマンガン(Mn)です。肺炎球菌は宿主であるヒト体内からMn2+イオンを奪って細胞内に取り込みますが、このMn2+イオンの「取り込み口」として働く膜輸送体がPsaBCです。どのようなしくみによりPsaBCがさまざまな金属イオンの中からMn2+イオンを選択的に取り込むのかという問題はこれまで十分に理解されていませんでした。
研究手法・成果
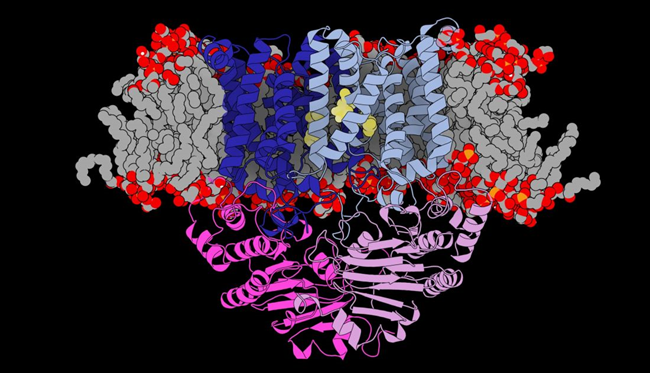
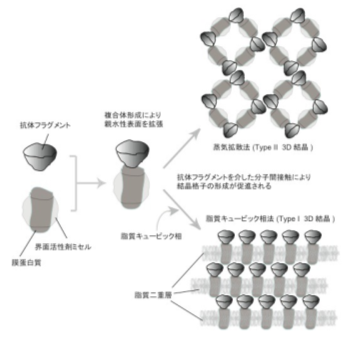
タンパク質など生体高分子の立体構造を研究する主要な手法の一つに、X線結晶構造解析法があります。膜タンパク質の立体構造をX線結晶構造解析法で解明する際には、目的の膜タンパク質を結晶化する必要がありますが、多くの場合これが非常に困難です。本研究では、抗体フラグメントを結晶化促進ツールとして用いる独自の膜タンパク質結晶化手法(図1)でこの困難を克服しました。大型放射光施設においてPsaBCタンパク質の結晶のX線回折実験を行い、その測定データを解析することにより、2.9 Å分解能での精密立体構造を決定しました(図2)。
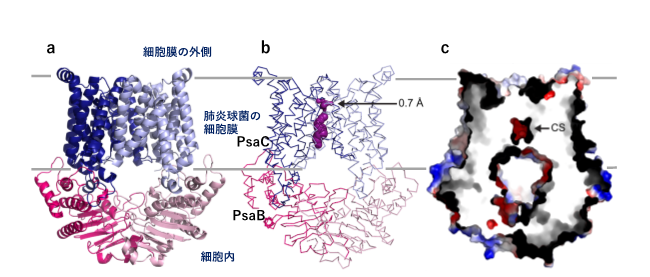
- 脂質二重膜と平行な視線から見たPsaBC。同じサブユニットが二つ組み合わさって会合して、膜輸送体としての機能を発揮する。わかりやすいように二つのサブユニットにのみ異なる彩色を施した。細胞膜内部分に見える螺旋状のものはPsaBCを構成する膜貫通ヘリックスである。
- aとほぼ同じ方向から見たPsaBC分子を構造表示法を変えて示した。膜内の紫色で示した部分がMn2+イオンの輸送経路である。輸送経路中に直径が0.7Åにまで幅が狭くなっているところがある。Mn2+のイオン半径が0.83Åであることを考えると、この狭窄部分の構造は、他のカチオン(Mg2+=0.72Å、Ca2+=1.00Å、Fe2+=0.78Å、Cu2+=0.73Å、Zn2+=0.74Å)や水(H2O=2.75Å)が不意に進入するのを防ぎ、また輸送中のMn2+イオンの「逆流」を防ぐしくみと考えられる。
- a, bとほぼ同じ方向から見たPsaBC分子の断面図。CSで示した部分が輸送途中のMn2+イオンが選択的に捕捉される部分(配位部位)である。遷移金属のトランスポーターは、静電気相互作用だけに頼るのではなく、さらに金属の配位相互作用を利用してイオンを通過させる。
PsaBCは同じサブユニットが二つ会合して働くホモ二量体ですが、立体構造を見ると二つのサブユニットが組み合わさることにより分子の中心部にMn2+イオン輸送経路が形成されていることがわかりました。イオン輸送経路内の表面にMn2+イオン親和性の高いアミノ酸残基が配置して効率的にMn2+イオンを捕捉すること、さらに一旦イオン輸送経路に入ったMn2+イオンが再び細胞外に出ていかないように細胞外側の開口部に「逆流防止ゲート」のような構造があることが特徴的です。このようなPsaBC独特の構造により、Mn2+イオンのような非常に小さなサイズの荷電体を選択的かつ巧妙に制御された方法で細胞膜を通過させるしくみ(図3)があることが明らかになりました。
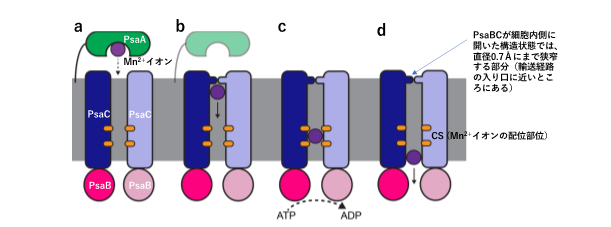
- Mn2+イオン(紫)を結合したPsaA(緑)がPsaC(青)と相互作用し、Mn2+イオンを輸送経路に放出する。
- PsaCの輸送経路にMn2+イオンが入った後、輸送経路の入り口部分が閉じて狭窄し、イオンの逆流を防ぐ。Mn2+は配位部位CS(橙)の負電荷環境に引き寄せられて輸送経路を移動する。
- PsaB(ピンク)とヌクレオチドの相互作用により、Mn2+イオンとCSとの相互作用が破壊される。ヌクレオチドの結合、加水分解、CSからのMn2+イオン放出に関してはまだ実験的に証明されていない部分が多い。
- CSの不安定化により、Mn2+イオンがPsaCから解離し、細胞質に放出される。
波及効果、今後の予定
本研究の成果は、肺炎球菌関連疾患に対する新しい治療薬の開発につながる可能性があります。肺炎球菌のワクチンはすでに存在しますが、既知の株に対して限定的な防御しかできません。また種々の抗生物質に対する耐性率が急速に上昇し、「スーパーバグ」(注1)が出現している現況では、抗生物質による肺炎球菌の増殖抑制にも限界があります。しかしながら、肺炎球菌細胞内へのMn2+イオンの補給路を断つことができれば、その増殖・病原性発現を抑えることが可能になります。今回得られた立体構造情報を用いてPsaBCのMn2+イオン輸送を遮断する生理活性をもつ新たな化合物を合理的に探索・開発することが、肺炎球菌関連疾患の新規治療薬開発のために今後重要な研究方針の一つになると考えられます。
研究プロジェクトについて
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の創薬等ライフサイエンス研究支援基盤事業(BINDS)JP21am0101079の支援を受けています。
論文タイトルと著者
- タイトル
- The structural basis of bacterial manganese import(肺炎球菌細胞内へのマンガンイオンの取り込みに関与する膜輸送体の立体構造と分子機構の解明)
- 著者
- Stephanie L. Neville, Jennie Sjöhamn, Jacinta A. Watts, Hugo MacDermott-Opeskin, Stephen J. Fairweather, Katherine Ganio, Alex Carey Hulyer, Aaron P. McGrath, Andrew J. Hayes, Tess R. Malcolm, Mark R. Davies, Norimichi Nomura, So Iwata, Megan L. O’Mara, Megan J. Maher, Christopher A. McDevitt.
- 掲載誌
- Science Advances
- DOI
- 10.1126/sciadv.abg3980
用語解説
- (注1):スーパーバグ
- 超多剤耐性菌または複数の抗生物質に耐性のある細菌のことである。どんな抗生物質を使ってもその増殖を抑制できないので細菌感染症の治療がきわめて困難になる。2014年の英国政府の報告書によると、スーパーバグの感染症により世界で毎年70万人以上が死亡すると見積もられている。医薬品や農畜産物を通じて抗生物質を人々が過剰摂取することが大きな原因の一つとなり、その結果として病院などの医療施設でスーパーバグの感染が広がるとされている。
お問い合わせ先
岩田 想(いわた そう)
京都大学医学研究科・教授
TEL:075-753-4372
E-mail:s.iwata“AT”mfour.med.kyoto-u.ac.jp
報道・取材に関するお問い合わせ先
京都大学 総務部広報課国際広報室
TEL:075-753-5729 FAX:075-753-2094
E-mail:comms“AT”mail2.adm.kyoto-u.ac.jp
AMED事業に関するお問い合わせ先
日本医療研究開発機構 創薬事業部 医薬品研究開発課
創薬等ライフサイエンス研究支援基盤事業(BINDS)
TEL:03-6870-2219
E-mail:20-ddlsg-16“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年10月13日
最終更新日 令和3年10月13日


