成果情報 ウレアプラズマによる宿主細胞死の回避―気配を消す流早産原因菌の戦略―
成果情報
地方独立行政法人大阪府立病院機構
大阪母子医療センター研究所免疫部門
J. Craig Venter Institute
国立研究開発法人産業技術総合研究所
国立研究開発法人日本医療研究開発機構
研究成果のポイント
- 主な流早産の原因であるウレアプラズマは、細胞内に感染し栄養を得て生存しているが、ウレアプラズマ空胞化因子(UpVF)は、感染細胞のマイクロRNA(注1)を調節することで小胞体ストレス(注2)を遮断し、感染細胞の細胞死を回避させていることを発見した。
- ウレアプラズマには遺伝子改変技術がなく、病原性の解析は困難であったが、ウレアプラズマ遺伝子をミニマルセル(注3)のゲノムに組み込むことに成功し、UpVFの病原性を明らかにした。
概要
ヒト流早産の3~5割は細菌感染によって引き起こされますが、母親に自覚症状が現れた時には感染や炎症が進んでいることがしばしばあります。そして子宮内での持続的な感染は、赤ちゃんの合併症(慢性肺疾患など)を悪化させます。
このほど、大阪母子医療センター・柳原格(やなぎはら いたる)部長を中心とする国際研究チーム(※1)は、流早産の原因として重要な細菌であるウレアプラズマが、感染した胎児や子宮の細胞の中で栄養を受け続けるために感染細胞を殺さないようしていることを発見しました。この感染細胞の細胞死を回避するメカニズムは、ウレアプラズマのUpVF(ウレアプラズマ空胞化因子)と名付けた蛋白質が担っていました。一方で、ウレアプラズマの遺伝子操作は困難なため、ウレアプラズマを改変してUpVFの解析はできません。そこで、最近大きな注目を集めている、人工的に合成したDNAから生物(細菌)を作りだす新技術(合成生物学)を使ってウレアプラズマの遺伝子を人工ゲノム細菌に導入することに世界で初めて成功し、UpVFの病原性を明らかにしました。UpVFは、ウレアプラズマが感染した細胞にその存在を悟られないようにするための気配を消す分子とも言え、早産や赤ちゃんの合併症を予防する新たな治療の標的となると期待されます。
本研究成果は、2021年10月11日付科学誌Cellular Microbiologyに発表されました。
- ※1
- 米国J Craig Venter Institute(John Glass教授)、国立研究開発法人産業技術総合研究所(柿澤茂行主任研究員)、近畿大学医学部救急医学講座(濱口満英講師)
研究背景
世界では、年間1,500万人の子供が早産で生まれ、年間100万人が早産とその合併症で亡くなっている(WHO)。また、5歳以下の子供の死亡原因の第1位は、早産で生まれることである(unicef)。早産原因の3割~半数は、腟からの細菌の上行感染であるとされている。我が国の早産(妊娠22週~37週未満)率は6%弱、年間55,000人が早産で生まれている。早産児の主な合併症には、新生児慢性肺疾患や神経系障害などがある。生後1か月(4週)未満の新生児死亡、および1歳未満の乳児死亡原因の第2位は、周産期に特異的な呼吸障害及び心血管障害である。流早産の多くに認める胎盤の炎症(絨毛膜羊膜炎)を解析し、マイコプラズマ科のウレアプラズマ細菌が高い頻度(42%)で検出されることが明らかにされた(Ped Res, 2010)。臨床的には、胎内での炎症の強さや、曝露期間が肺や神経系の予後を左右するとされる。また、早産を起こす母体の多くは、自覚症状(発熱やおなかの張りなど)を訴えた際にはすでに胎内の炎症が進行していることがあり、早産の制御は今なお周産期医療最大の課題である。
ウレアプラズマは、最小病原細菌の一つで、病院検査室の顕微鏡検査では観察できないため、特殊な培養やPCR検査などで検出している。その名の示す通り、尿素(ウレア)からエネルギー(ATP)を得ており、泌尿生殖器から分離される。胎児の尿が主体の羊水は、ウレアプラズマにとっては格好の増殖環境と言える。ウレアプラズマは、ヒトの胎盤や胎児の細胞に侵入することで、母体の抗体などの免疫系をすり抜けている可能性が示された。また、細胞内に侵入したウレアプラズマは、細胞内で分解や病原体の殺菌をつかさどる膜(オートファジー)を抜け出し増殖したが、その機序は不明であった(MicrobiologyOpen, 2017)。
研究成果
UpVFの発見と宿主細胞の小胞体ストレスへの影響
ウレアプラズマの機能不明な遺伝子を酵母を用いてスクリーニングした結果、酵母の生育を阻害する遺伝子を同定した。この遺伝子をヒト培養細胞に導入したところ、細胞の膜の異常を示す大小さまざまな「空胞」を形成したため、ウレアプラズマ空胞化因子(UpVF)と名付けた(図1:黄色矢印)。ウレアプラズマと小胞体の関係について蛍光顕微鏡及び電子顕微鏡で観察したところ、ウレアプラズマはヒト細胞に感染後、細胞内の細胞内小器官(小胞体)と共局在していた。
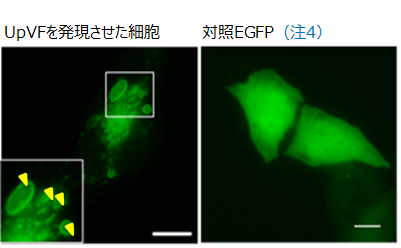
ウレアプラズマ及びUpVFが小胞体ストレスに及ぼす影響について調べた結果、ウレアプラズマおよびUpVFは小胞体ストレスのATF4、CHOP、XBP1を遮断した。さらにATF4、CHOP、XBP1といった小胞体ストレスを遮断するメカニズムについて調べるため、ヒト細胞の全マイクロRNA(miRNA)の変化を調べた結果、UpVF発現細胞株では小胞体ストレスを遮断するmiR-211、-214の発現上昇を認めた。これらのmiRNAの阻害を行ったところ、アポトーシス(注5)が誘導されたことから、UpVFはこれらのmiRNAを介して宿主の細胞死を制御していることが示された。
ミニマルセルを用いたUpVFの機能解析
ウレアプラズマには、遺伝子変異の導入や遺伝子を欠損させるといった遺伝子改変システムが存在しないため、米国J. Craig Venter Institute、国立研究開発法人産業技術総合研究所との共同研究にて、全合成したゲノムから構成された人工ゲノム細菌ミニマルセル(JCVI-syn3.0B)にウレアプラズマの遺伝子を組込む方法を開発した。この技術によって、ウレアプラズマの蛋白質を発現したミニマルセルが作製できるようになった。
ウレアプラズマの遺伝子を導入していないミニマルセル(JCVI-syn3.0B)は生きるための最小限の遺伝子しか持たない。そのため、ヒトの培養細胞には接着することができない。そこでウレアプラズマの外膜リポ蛋白質のMBAを発現させたミニマルセルを作製したところ、培養ヒト細胞に接着性が確認された(図2A、Syn-MBA:黄色矢印)。さらにMBAとUpVFの両方を同時に発現させたミニマルセル(Syn-MBA-UpVF)を培養ヒト細胞に感染させたところ、感染6時間後には、感染細胞は非感染コントロールに比べて細胞表面全体が不正で膜の障害が起きていた。
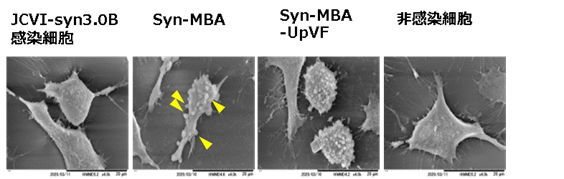
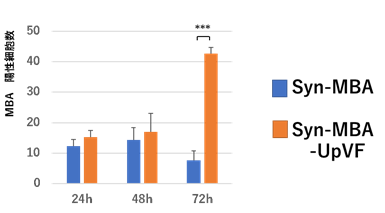
Syn-MBA-UpVF感染6時間後には生存している細胞数が一時的に減少したものの、その後細胞数は増えた(図2B)。Syn-MBA-UpVF感染細胞では、細胞死の経路が抑制されたことで細胞数が増えたものと考えられた。ミニマルセルを用いたウレアプラズマの遺伝子の発現に成功するとともに、感染細胞の影響解析も可能となった。
今後への期待
UpVFの機能を抑制することで、ヒト細胞がウレアプラズマの細胞内感染を早期に感知ができれば、小胞体ストレスを通じて本来ヒトに備わっている病原体排除機構を作動させることが可能となる。このことからUpVFは新規治療の標的となりえる。世界で初めてウレアプラズマ遺伝子をミニマルセルに導入し機能解析に成功した。我が国におけるミニマルセルを用いた初めての報告であり「日本の合成生物学の幕開け」となった。
研究費
AMED「新興・再興感染症に対する革新的医薬品等開発推進研究事業」(柳原早産研究班)
日本学術振興会科学研究費(西海、吉村、柳原)
中谷医工計測技術振興財団「特別研究助成」(柳原)
米国National Science Foundation MCB program(Glass)
論文情報
- 掲載雑誌
- Cell Microbiol. 2021 Sep 7;e13392.
- タイトル
- Blockade of endoplasmic reticulum stress-induced cell death by Ureaplasma parvum vacuolating factor.
- 著者名
- Fumiko Nishiumi1, Yasuhiro Kawai1,2, Yukiko Nakura1, Michinobu Yoshimura1, Heng Ning Wu1, Mitsuhide Hamaguchi3,4, Shigeyuki Kakizawa5, Yo Suzuki6, John I Glass6, Itaru Yanagihara1
- 所属
-
- Department of Developmental Medicine, Research Institute, Women's and Children's Hospital, Izumi-city, Osaka, Japan.
- Health Evaluation Center, Kanazawa Medical University Himi Municipal Hospital, Himi-city, Toyama, Japan.
- Department of Anesthesia, Critical Care and Pain Medicine, Massachusetts General Hospital, Harvard Medical School, Charlestown, Boston, MA, USA.
- Department of Emergency and Critical Care Medicine, Kindai University Faculty of Medicine, Osakasayama-City, Osaka, Japan.
- National Institute of Advanced Industrial Science and Technology, Tsukuba, Ibaraki, Japan.
- Synthetic Biology Group, J. Craig Venter Institute, La Jolla, California, United States.
- doi
- 10.1111/cmi.13392
用語説明
- (注1)マイクロRNA(miRNA)
- 21-25塩基長の1本鎖RNA分子であり真核生物において遺伝子の転写後発現調節に関与する。
- (注2)小胞体ストレス
- 我々の細胞は病原細菌に感染し、ひどく損傷を受けると細胞死が誘導される。しかし、個々の細胞には、損傷を乗り越え、細菌を排除するための自律防御機構も存在する。これらの反応の多くは、細胞の恒常性(ホメオスタシス)の異常を検知することで引き起こされる。一連の反応では、タンパク質翻訳やミトコンドリア呼吸などの必須細胞機能を低下させ、特異的な自然免疫反応を誘発することで病原体に抵抗する。これらの自律防御機構の発動は、小胞体などの細胞内小器官が検知し、順次応答する。非感染時にも、小胞体のホメオスタシスが乱れると、アンフォールド(機能的な構造に折り畳まれていない)タンパク質が蓄積し、それが小胞体ストレスセンサーに検出され小胞体ストレス応答(UPR)が起こり、やがて細胞は正常な状態に戻されていく。一方で、処理しきれない小胞体ストレス応答が起こると細胞死(アポトーシス)が引き起こされる。
- (注3)ミニマルセル
- 米国ベンター研究所において作成された細菌のこと。ミニマルセルであるJCVI-syn3.0菌株は、ウレアプラズマに近縁なマイコプラズマの一種(Mycoplasma mycoides subsp. Capricolum)をベースに作成され、生命の維持に欠かせない最少の473遺伝子のみを持つため、増殖以外の機能を持たないと考えられる。その作成方法は、最少のゲノムを人工的に設計・合成し、合成したDNA断片を酵母の中でつなぎ合わせ、それをマイコプラズマ科の細菌の中に導入し、選択を行う方法であり、これにより人工ゲノム生物(細菌)を作り上げることに成功した。本研究に用いた菌株はJCVI-syn3.0Bであり、これはJCVI-syn3.0に十数個の遺伝子が追加で導入された菌株であり、細胞の形態が均一になっている。なお人工のゲノムや遺伝子断片を用いて生命現象を紐解く研究は「合成生物学(synthetic biology)」と呼ばれる。
- (注4)EGFP
- 緑色蛍光タンパク質はオワンクラゲの緑色の蛍光性をもつタンパク質。
- (注5)アポトーシス
- 多細胞生物の体を構成する細胞死の一種で、発生段階や、個体をより良い状態に保つためなどの際に積極的に引き起こされるプログラムされた細胞死のことをいう。
本件に関するお問い合わせ先
報道に関すること
地方独立行政法人大阪府立病院機構
大阪母子医療センター
事務局 総務人事グループ 中野嘉子(なかの よしこ)
TEL:0725-56-1220(内線3272)
E-mail:nakanoyos“AT”opho.jp
研究に関すること
地方独立行政法人大阪府立病院機構
大阪母子医療センター
研究所免疫部門・部長 柳原格(やなぎはら いたる)
E-mail:itaruy“AT”wch.opho.jp
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部 創薬企画・評価課
新興・再興感染症に対する革新的医薬品等開発推進研究事業
TEL:03-6870-2226
E-mail:shinkou-saikou“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和3年10月20日
最終更新日 令和3年10月20日


