成果情報 光合成細菌の高エネルギー変換を支える新しいタンパク質を発見―産業利用されている光合成細菌ロドバクター・スフェロイデスの光捕集構造の可視化により、太陽光エネルギー活用に新たな示唆―
成果情報
三重大学
沖縄科学技術大学院大学
日本医療研究開発機構
- 光合成の際に酸素を発生しない「光合成細菌」であるロドバクター・スフェロイデスの光捕集反応中心複合体をクライオ電子顕微鏡により立体的に可視化することに成功
- ロドバクター・スフェロイデスの非常に高効率な光捕集メカニズムは、肥料や食品の原料として使用されている5―アミノレブリン酸の生合成などで利用されており、太陽光エネルギーの多様かつ効率的な利用のヒントになると期待
- 光合成細菌は農業や環境分野での活用が進められてきたが、今回高エネルギー変換を支える新しいタンパク質(命名protein-U)を発見したことで、今後の光合成細菌の品種改良に貢献
- 長らく構造未知であった光合成タンパク質PufXを含んだ状態で可視化でき、その相互作用やキノンの経路を含めて解明
- 他種と比較して2倍のカロテノイド含量をもち、光捕集反応中心複合体での新たな結合位置とその特徴を解明
概要
三重大学医学系研究科の谷一寿特任教授、溝口明教授、茨城大学の大友征宇教授、沖縄科学技術大学院大学のBruno humbel博士らは、微生物発酵などの利用が進んでいる光合成細菌の一種Rhodobacter sphaeroides(ロドバクタ―・スフェロイデス)(Rba. sphaeroides)の「膜タンパク質コア光捕集反応中心複合体(LH1-RC)*1」をクライオ電子顕微鏡*2により立体的に可視化することに成功しました。
コア光捕集反応中心複合体は、光合成細菌が光エネルギーを集め、電子変換し、伝達することを可能にしている膜たんぱく質です。特に今回は、高エネルギー変換を支える新奇膜タンパク質protein-U*3が複合体の中に含まれていることを突き止め、それが結合した状態で可視化できた初めての例となります。さらに遺伝子研究の技法(ノックアウト株)を活用し、この新奇タンパク質の機能も明らかにしました。
加えて、可視化により、光捕集反応中心複合体へのキノン流入出に関与していると考えられてきた膜タンパク質の一種であるPufX*4の立体構造とその位置が明らかにされたことで、光の捕集からキノンを介した電子伝達の経路も予想することもできました。
また、ロドバクター・スフェロイデスの複合体は、これまでに立体構造が解明されている他の光合成細菌の複合体に較べてカロテノイド*5の含量が2倍であることが知られていましたが、どこにカロテノイドが余分に結合し相互作用するのかわかっていませんでした。本研究によりバクテリオクロロフィル*6と従来型のカロテノイド位置に挟まれた箇所に新たな結合サイトが存在することがわかりました。
三重大学、茨城大学、沖縄科学技術大学院大学、神奈川大学、中国科学院植物研究所、神戸大学、南イリノイ大学の国際共同研究によるこの成果は、学術誌「Nature communications」に2021年11月2日オンライン掲載されました。
背景
光合成を行う際、植物やシアノバクテリアでは酸素を発生しますが、光合成細菌は酸素を発生せず、非常に高い効率で太陽の光を電子エネルギーへ変換できるように進化してきました。棲息環境は淡水から海水まで幅広く種ごとに適応し、光捕集において補助的な効果をもつカロテノイド類にも種類・含有量に差がみられるなどバラエティーに富んでいます。どの光合成細菌も太陽の光エネルギーを利用するという点では同じなのですが、環境に応じて光捕集メカニズムが最適な装置になるようそれぞれが進化のバイアスを受けています。
また、光合成細菌の光合成は、酸素発生型である植物の光合成と類似の部分もありますが、酸素非発生型として効率を重視した独自の進化過程を遂げたことがわかっています。一方で、独自に発展した立体構造と機能との相関性は不明な部分も多く、発酵培養などで広く利用されている光合成細菌ロドバクター・スフェロイデスの光捕集反応中心複合体も謎とされてきました。
光合成細菌は、田んぼや温泉など身近なところに生息しています。本種を含め農作物にとっての有害物質を栄養とし、有益な栄養分を排出するようなものは多く、化学物質に頼らない農業への活用も進められてきました。また、非常に高いエネルギー変換効率を持つことが知られており、酸素を発生しない光合成のメカニズムの解明は、様々な分野から期待が寄せられています。
研究内容
長らく構造未知であった1回膜貫通型膜タンパク質PufXを含むロドバクター・スフェロイデスのコア光捕集反応中心複合体(LH1-RC)については、他の種と異なりLH1-RCが二量体形成(同じ単量体ユニットが二つ集まった分子)もできることが知られており、そのカギとなるPufXの寄与メカニズムを明らかにするためNMRなどの構造解析が行われてきました。しかし複合体内でのメカニズムについては未解明で、今回の研究結果であるクライオ電子顕微鏡を用いた単粒子解析法によりようやく明らかにすることができました(図1)。解析手法の改善により200kV加速電圧のクライオ電子顕微鏡でも2.9Å分解能で決定することができ、これまでhypothetical proteinとしてゲノム情報内での存在であった膜タンパク質が複合体に含まれていることを見出し、protein-Uと命名しました(図2A)。機能未知のタンパク質であったことから、ノックアウト株による実験を行ったところ、LH1-RCの二量体形成を安定化させることがわかりました(図2B)。
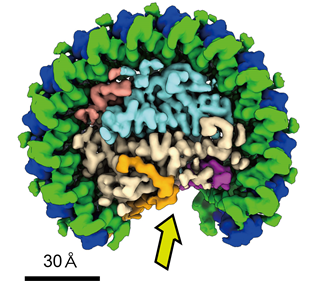
黄矢印で指した部分はキノンの出入口。
発見したprotein-U(マゼンタ色)。可視化できたPufX(橙色)。
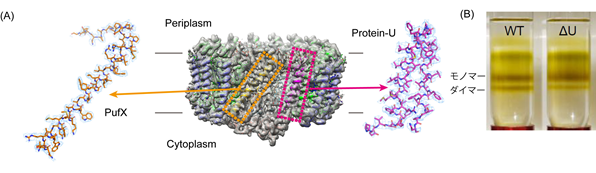
また、分光学からカロテノイド含量が他種の2倍あることが知られていましたが、実際構造可視化により、新らたな結合位置が明らかになり既存と新規の両様式で相互作用していることが明らかになりました(図3)。
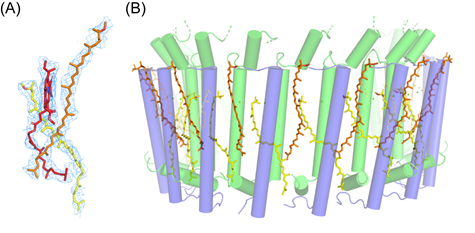
また、キノンの流入出とPufXの関連性が複合体構造からも支持されており、光合成の効率向上に一役買っていることもわかりました。PufXとともに、protein-Uが、この出入口を形成していることから、今回の詳細な三次元構造が、新たなキノンの流入出経路のモデルと、さらなる高効率化の可能性を含めて提示することができました。
今後の展望
酸素を発生しない光合成細菌による光合成は、進化的に原始的なものですが、非常に高い効率性を実現しています。既に、私たちの暮らしにとって有益な分子の生合成といった産業利用もなされています。本研究で可視化したメカニズムは、生物工学でも利用されているロドバクター・スフェロイデスの効率向上の研究を進めるだけでなく、太陽光エネルギーの人工的利用の更なる発展に貢献することも期待できます。また、本種は廃液処理や生分解性プラスチックといった分野でも利用が研究されており、明らかにしたメカニズムを基に、地球環境保全・SDGsの達成にも寄与していきたいと考えています。
用語解説
- *1 コア光捕集反応中心複合体(LH1-RC)
- 光エネルギーをアンテナタンパク質(LH1)で効率的に捕集し、反応中心(RC)へ伝え、光から電子への変換を行い、キノン類を介して電子を伝達する複合体膜タンパク質。
- *2 クライオ電子顕微鏡
- 生体の高分子構造を立体的に解析できる手法の一種。2017年ノーベル化学賞。
- *3 protein-U
- 新しく発見した2回膜貫通型膜タンパク質であり、そのノックアウト株の作製により、その機能はLH1-RC二量体化を安定させることであることが判明した。
- *4 PufX
- 長らく構造未知であった1回膜貫通型膜タンパク質であり、これまでのノックアウト株の結果から欠損するとLH1-RC二量体が見当たらず単量体になるだけでなく、光栄養成長できないことがわかっていた。
- *5 カロテノイド
- 植物、藻類、光合成細菌が生合成している天然色素で、イソプレンが直鎖状に結合した基本骨格をもつ。光合成においては、光捕集の補助的役割や、光が強すぎるときの保護作用、抗酸化作用を担っている。
- *6 バクテリオクロロフィル
- 光合成時の光吸収に際して、植物がクロロフィルを用いるように、光合成細菌はバクテリオクロロフィルを用いており、化学的にも両者は似ている。
論文情報
- 掲載誌
- Nature communications
- 掲載日
- 2021年11月2日(On line版)
(https://doi.org/10.1038/s41467-021-26561-9) - 論文タイトル
- A Previously Unrecognized Membrane Protein in the Rhodobacter sphaeroides LH1-RC Photocomplex
- 著者
- Kazutoshi Tani, Kenji V. P. Nagashima, Ryo Kanno, Saki Kawamura, Riku Kikuchi, Malgorzata Hall, Long-Jiang Yu, Yukihiro Kimura, Michael T. Madigan, Akira Mizoguchi, Bruno M. Humbel, and Zheng-Yu Wang-Otomo
研究支援について
本研究は、国立研究開発法人日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業(BINDS)JP21am0101118,JP21am0101116等の支援を受けて実施されました。
本件に関するお問合せ
三重大学医学研究科 谷一寿 特任教授
TEL:059-231-5687
E-mail:ktani“AT”doc,medic,mie-u.ac.jp
沖縄科学技術大学院大学 Bruno Humbel 博士
E-mail:Bruno.Humbel“AT”oist.jp
茨城大学理工学研究科 大友征宇 教授
E-mail:seiu.otomo.sci“AT”vc.ibaraki.ac.jp
AMED事業に関するお問合せ
日本医療研究開発機構 創薬事業部 医薬品研究開発課
創薬等ライフサイエンス研究支援基盤事業(BINDS)
TEL:03-6870-2219
E-mail:20-DDLSG-16“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年11月5日
最終更新日 令和3年11月5日


