iPS細胞を用いてヘルマンスキー・パドラック症候群の肺病態の解析に成功―研究が困難な遺伝性疾患の治療薬開発の足がかりに―
成果情報
京都大学大学院
杏林製薬株式会社
日本医療研究開発機構
概要
間質性肺炎は呼吸時のガス交換を担う肺胞の壁が徐々に固くなることで、呼吸機能が低下する病気です。ヘルマンスキー・パドラック症候群1型の患者さんの多くは間質性肺炎になってしまうことが分かっていますが、患者さんから肺胞の細胞を単離・培養することは難しいため、この病気の研究は進んできませんでした。
京都大学大学院医学研究科 呼吸器疾患創薬講座 後藤慎平特定准教授、末澤隆浩同研究員らは、形態形成機構学 萩原正敏教授、呼吸器内科 平井豊博教授、杏林製薬株式会社創薬本部 村上浩二創薬企画部長との共同研究において、ヘルマンスキー・パドラック症候群1型の患者さん由来のiPS細胞から肺の上皮細胞を作製して病気の原因を探索しました。その結果、患者さんから作製したiPS細胞では、肺の元となる肺芽オルガノイド注1において枝状構造が減少すること、また肺胞上皮細胞注2において細胞内のエネルギー産生に重要なミトコンドリアの機能が低下していることを発見しました。本研究成果は、ヘルマンスキー・パドラック症候群1型の病気の発症メカニズムの解明や治療薬の開発に役立つことが期待されます。
本成果は、2021年11月4日に国際学術誌「Respiratory Research」にオンライン掲載されました。
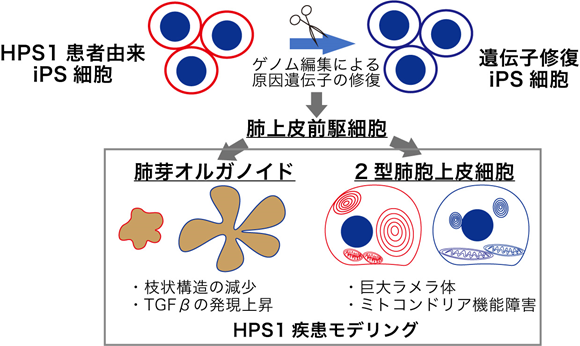
背景
間質性肺炎は肺のガス交換を担う肺胞に繰り返し炎症や損傷が起こることで、肺胞の壁が徐々に固くなり呼吸機能が低下する病気です。肺胞に障害が起きる原因はさまざまですが、遺伝的に肺胞上皮細胞に障害を受けやすい患者さんがいます。ヘルマンスキー・パドラック症候群(HPS)は、白皮症や視覚異常、出血時間の延長などを特徴とする遺伝性の病気です。HPSは原因となる遺伝子によって複数の型があり重症度も異なりますが、中でもヘルマンスキー・パドラック症候群1型(HPS1)は患者さんの数が最も多く、重篤な間質性肺炎を示すことが知られています。ヒトと実験動物(マウス)の肺には種差があるため、ヒトの細胞でも病気の原因を探索・検証することは重要です。一方で、患者さんから肺胞上皮細胞を採取すること、またその機能を維持したまま長期間培養することが困難であるため、HPS1のヒト細胞を用いた研究は進んできませんでした。
2014年に本研究グループはヒトiPS細胞から肺上皮前駆細胞注3を効率よく作製することに成功しました(参考文献1)。さらに肺上皮前駆細胞から機能的な気道上皮細胞や肺胞上皮細胞が作製できることを示しました(参考文献2、3)。2019年には幼少期から間質性肺炎を発症するヘルマンスキー・パドラック症候群2型(HPS2)の患者さん由来のiPS細胞を用いて2型肺胞上皮細胞からの肺サーファクタント注4の分泌異常を報告しました(参考文献4)。そこで今回の研究では成人してから特徴的な間質性肺炎を発症したHPS1患者さんから作製したiPS細胞を用いて肺胞オルガノイドに分化誘導し、その特徴を解析することでHPS1患者さんが間質性肺炎を発症する原因を探したいと考えました。
研究手法・成果
海外の細胞バンク(Coriell Institute for Medical Research)から入手したHPS1患者さん由来の線維芽細胞からiPS細胞を作製し、ゲノム編集注5によりHPS1遺伝子の変異を修復したiPS細胞を作製することで比較対照となる細胞を取得しました。それらのiPS細胞から肺上皮前駆細胞を作製し、以下に示す2種類の培養方法を用いて作製した細胞の特徴を比較解析しました。
肺芽オルガノイド
肺の発生過程において、肺芽と呼ばれる肺の元となる構造が初めにでき、そこから枝分かれした気道の先端に肺胞構造が作られることで肺が完成すると考えられています。米国の研究チームからは、HPS1遺伝子を欠損したES細胞注6を用いて肺芽オルガノイドを作製すると、肺芽の枝状構造が弱まることが報告されていました(参考文献5)。今回の研究では、まずは肺芽オルガノイドの作製法を改良した上で、HPS1患者さんのiPS細胞から分化誘導した肺芽オルガノイドを用いたところ、この枝状構造は弱まることが分かりました。さらにHPS1患者さんのiPS細胞から作製した肺芽オルガノイドでは、間質性肺炎を引き起こすと考えられているTGFβが増えており(図1A)、またその作用を止めることで枝状構造が回復することを確認しました(図1B)。
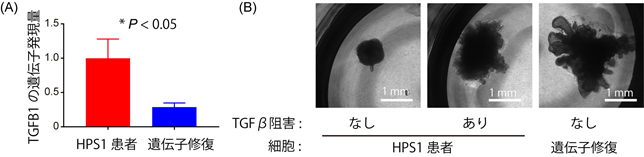
(A)TGFB1の発現量 (B)形態の観察
肺胞オルガノイド
本研究グループは、肺上皮前駆細胞と肺線維芽細胞注7を一緒に培養し肺胞オルガノイドとすることで、効率よく2型肺胞上皮細胞を作製できることを過去に報告しました(参考文献3)。HPS1患者さんの肺の2型肺胞上皮細胞では、肺サーファクタントを貯めるラメラ体注8が肥大化することが知られており(参考文献6)、今回本研究グループが作製したHPS1患者さん由来のiPS細胞から作製した2型肺胞上皮細胞においても同様の肥大化したラメラ体を観察することが出来ました(図2A)。さらにこの細胞の中のタンパク質を詳細に解析した結果、細胞内のエネルギー産生に重要な役割を持つミトコンドリアの機能が低下している可能性が示されました。ミトコンドリアの機能を示すものの一つにミトコンドリアの膜電位があります。実際に、HPS1患者さん由来のiPS細胞から作製した2型肺胞上皮細胞では、ミトコンドリアの膜電位が低下した細胞が増えていることが分かりました(図2B)。
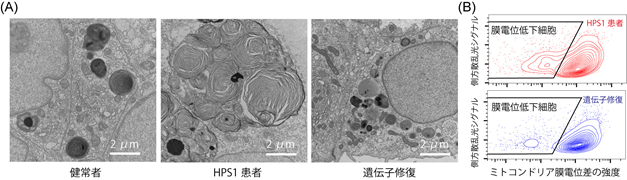
(A)ラメラ体の観察 (B)ミトコンドリア膜電位の評価
今回の研究で作製したHPS1患者さん由来のiPS細胞は、これまでの研究報告や実際の患者さんの病態をよく再現できているため、HPS1患者さんの病気の発症メカニズムの解明や治療薬の開発に役立つことが期待されます。
波及効果、今後の予定
患者さん由来のiPS細胞を用いた解析において、肺芽オルガノイドではTGFβの活性化がHPS1の肺病態の形成に関与している可能性を示しました。一方でこのオルガノイドに含まれる細胞は胎児の細胞に似ており、成熟した肺の上皮細胞であることまでは示すことが出来ませんでした。病態の責任細胞の1つとして考えられてきた2型肺胞上皮細胞で見出されたミトコンドリア機能の低下も治療標的となる可能性があります。これらの特徴が実際のヒトの病態と関連するかどうかは今後検証していく必要があります。また、間質性肺炎では、肺胞上皮細胞の障害とそれに続く周囲の線維芽細胞の異常な活性化が病態形成に関与していると考えられていますが、今回の肺胞オルガノドを用いた解析では、肺胞上皮細胞を解析出来ましたが、線維芽細胞についてはまだ十分に解析できていません。今後は、線維芽細胞の解析も行うことで、HPS患者さんが間質性肺炎を発症する原因を解明していきたいと考えています。
研究プロジェクトについて
本研究は、下記機関より資金的支援を受けて実施されました。
杏林製薬株式会社、日本医療研究開発機構 再生医療実現拠点ネットワークプログラム 幹細胞・再生医学イノベーション創出プログラム「多能性幹細胞を用いたヒト由来肺組織シミュレーターの創出」、日本学術振興会・文部科学省 科学研究費補助金。
用語説明
- 注1 オルガノイド
- 培養皿の中で増殖能と分化能を持った細胞からつくられた臓器に似た立体構造体で複数種の細胞から構成されています。「ミニ臓器」とも呼ばれます。
- 注2 肺胞上皮細胞
- 肺でのガス交換を担う肺胞の表面に存在する細胞。1型肺胞上皮細胞は、扁平な構造を取ることで効率の良いガス交換を担っています。2型肺胞上皮細胞は肺サーファクタントを分泌し、分裂増殖して肺胞上皮細胞に分化することで呼吸時の肺胞構造の維持に関与しています。
- 注3 肺上皮前駆細胞
- 幹細胞から、気道または肺胞上皮細胞に分化する途中の段階にある細胞。
- 注4 肺サーファクタント
- 2型肺胞上皮細胞から肺胞の空気が入る側に分泌される界面活性物質で、呼吸時に肺胞がつぶれてしまうことを防ぐ働きがあります。
- 注5 ゲノム編集
- ゲノムDNAを切断する酵素と切断する位置を決めるRNAを細胞に取りこませることで、狙った位置のゲノムDNA配列を改変する技術。
- 注6 ES細胞
- 理論上は全ての細胞に分化することができる胚性幹細胞のこと。作製するためには受精卵が必要であるため、様々な希少疾患の患者さんからES細胞を作製するには倫理面でも限界があります。
- 注7 肺線維芽細胞
- 肺の結合組織を構成する細胞の一つ。間質性肺炎においては、線維芽細胞が異常に活性化して過剰量のコラーゲンを分泌することで肺胞の壁が固くなり肺が収縮すると考えられています。
- 注8 ラメラ体
- 2型肺胞上皮細胞内に存在し、肺サーファクタントを貯蔵するための細胞小器官。肺サーファクタントの主成分であるリン脂質が規則正しく並ぶことで、特徴的な層状構造をとります。
参考文献
- Gotoh, S. et al. Generation of alveolar epithelial spheroids via isolated progenitor cells from human pluripotent stem cells. Stem Cell Reports 3, 394-403, doi:10.1016/j.stemcr.2014.07.005(2014).
- Konishi, S. et al. Directed Induction of Functional Multi-ciliated Cells in Proximal Airway Epithelial Spheroids from Human Pluripotent Stem Cells. Stem Cell Reports 6, 18-25, doi:10.1016/j.stemcr.2015.11.010(2016).
- Yamamoto, Y. et al. Long-term expansion of alveolar stem cells derived from human iPS cells in organoids. Nat Methods 14, 1097-1106, doi:10.1038/nmeth.4448(2017).
- Korogi, Y. et al. In Vitro Disease Modeling of Hermansky-Pudlak Syndrome Type 2 Using Human Induced Pluripotent Stem Cell-Derived Alveolar Organoids. Stem Cell Reports 12, 431-440, doi:10.1016/j.stemcr.2019.01.014(2019).
- Chen, Y. W. et al. A three-dimensional model of human lung development and disease from pluripotent stem cells. Nat Cell Biol 19, 542-549, doi:10.1038/ncb3510(2017).
- Nakatani, Y. et al. Interstitial pneumonia in Hermansky-Pudlak syndrome: significance of florid foamy swelling/degeneration(giant lamellar body degeneration)of type-2 pneumocytes. Virchows Arch 437, 304-313, doi:10.1007/s004280000241(2000).
論文タイトルと著者
- タイトル
- Modeling of lung phenotype of Hermansky-Pudlak syndrome type I using patient-specific iPS cells(疾患特異的iPS細胞を用いたヘルマンスキー・パドラック症候群1型の肺病変の疾患モデリング)
- 著者
- Takahiro Suezawa, Shuhei Kanagaki, Yohei Korogi, Kazuhisa Nakao, Toyohiro Hirai, Koji Murakami, Masatoshi Hagiwara, Shimpei Gotoh
- 掲載誌
- Respiratory Research
- DOI
- 10.1186/s12931-021-01877-8
お問い合わせ先
研究に関するお問い合わせ先
後藤慎平(ごとう しんぺい)
京都大学大学院医学研究科 呼吸器疾患創薬講座・呼吸器内科学 特定准教授
TEL:075-753-4352 FAX:075-753-4414
E-mail:gotoh.shimpei.5m“AT“kyoto-u.ac.jp
報道・取材に関するお問い合わせ
京都大学 総務部広報課国際広報室
TEL:075-753-5729 FAX:075-753-2094
E-mail:comms“AT“mail2.adm.kyoto-u.ac.jp
AMED事業に関する問い合わせ先
日本医療研究開発機構(AMED)
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課
TEL:03-6870-2220 FAX:03-6870-2242
再生医療実現拠点ネットワークプログラム
E-mail:saisei“AT“amed.go.jp
E-mailアドレスは、“AT“を”@”に変えて使ってください。
関連リンク
掲載日 令和3年11月29日
最終更新日 令和3年11月29日


