成果情報 iPS細胞を用いて作製した肺胞オルガノイドで間質性肺炎の病態再現に成功―治療満足度の低い間質性肺炎の治療薬開発に向けて前進―
成果情報
京都大学大学院
杏林製薬株式会社
日本医療研究開発機構
概要
間質性肺炎は、呼吸機能を担う肺胞上皮細胞注1が繰り返し傷害を受けることにより、傷の修復を担う線維芽細胞注2が異常に活性化し、肺胞の壁が固くなってしまうことで呼吸機能が低下する病気であると考えられています。間質性肺炎の病態形成には肺胞上皮細胞と線維芽細胞の相互作用が重要である一方で、この相互作用を培養皿の中で再現することが難しかったため、間質性肺炎の治療薬の開発は困難を伴ってきました。
京都大学大学院 医学研究科 呼吸器疾患創薬講座 後藤慎平特定准教授、末澤隆浩同研究員らは、形態形成機構学 萩原正敏教授、呼吸器内科 平井豊博教授、杏林製薬株式会社 村上浩二創薬企画部部長らとの共同研究において、iPS細胞から分化誘導した肺胞上皮細胞と線維芽細胞を一緒に培養して作製した肺胞オルガノイド注3を用いて、培養皿の中で間質性肺炎の病態を再現することに成功しました。今回構築した試験系は、肺胞上皮細胞の老化や分化状態の異常、線維芽細胞の収縮やコラーゲンの蓄積などが観察でき、ヒトの間質性肺炎で認められる病態を良く再現しています。本研究は間質性肺炎に対して新しいメカニズムを持つ薬の開発に役立つことが期待されます。
本成果は、2021年11月19日に国際学術誌「Stem Cell Reports」にオンライン掲載されました。
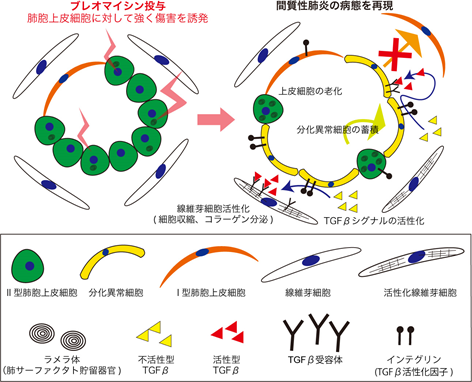
背景
間質性肺炎は、運動時の息切れや空咳といった症状から始まる進行性の病気です。間質性肺炎の発症には、呼吸機能を担う肺胞上皮細胞が繰り返し傷害を受けることによって傷の修復を担う線維芽細胞が異常に活性化し、肺胞の壁が固くなって肺が収縮してしまうことが知られています。間質性肺炎には、線維芽細胞を標的とし病気の進行を抑える薬はありますが、病気の発症そのものを抑える薬や症状を回復させる薬はまだありません。間質性肺炎の病態形成において肺胞上皮細胞と肺線維芽細胞の相互作用が重要である一方で、この相互作用を培養皿の中で再現することが難しかったため、肺胞上皮細胞の傷害や上皮細胞と線維芽細胞の相互作用を標的とする間質性肺炎の治療薬開発は進んできませんでした。
2017年に本研究グループは、ヒトiPS細胞から分化誘導した肺胞上皮細胞を肺線維芽細胞と一緒に培養ゲルの中で培養して肺胞オルガノイドを作製することで、肺胞上皮細胞を長期間培養することに成功しました(参考文献1)。そこで本研究グループでは、iPS細胞を用いて作製した肺胞オルガノイドに間質性肺炎の原因となる薬剤を投与することで、培養皿の中で間質性肺炎を再現できるのではないかと考えました。
研究手法・成果
iPS細胞から肺胞上皮細胞を分化誘導し、培養ゲルの中で肺の線維芽細胞と一緒に培養することで肺胞オルガノイドを作製しました。その肺胞オルガノイドにブレオマイシン注4を投与する実験を行い、以下の順番で解析を行いました。
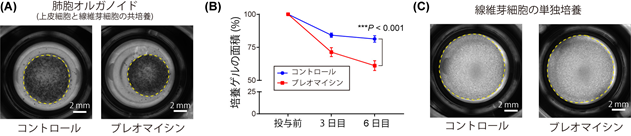
ブレオマイシンによって生じる肺胞オルガノイド中の線維芽細胞の収縮
傷が治る初期の過程において、線維芽細胞は傷口に集まり、周囲の組織を引っ張りながら細胞自身が収縮することで、傷口をふさごうとします。また間質性肺炎においても、線維芽細胞の過剰な収縮が観察されます。この線維芽細胞の収縮力を評価するために、培養ゲルの中で線維芽細胞を培養し、そのゲルの面積を測るということが行われてきました。ブレオマイシンを投与した肺胞オルガノイドでは培養ゲルの面積が小さくなったことから、ブレオマイシンによって肺胞オルガノイド中の線維芽細胞の収縮力は強くなったことが分かりました(図1A、B)。また、単独で線維芽細胞を培養したゲルにおいては、ブレオマイシンを投与してもゲルの面積が変化しませんでした(図1C)。このことから、ブレオマイシンによって肺胞オルガノイド中の線維芽細胞の収縮力が強くなったのは、肺胞オルガノイド中の上皮細胞に原因がある可能性が示されました。
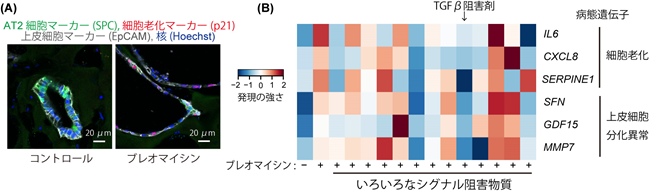
ブレオマイシンによって生じる肺胞上皮細胞の病態解析と病態の原因の探索
2型肺胞上皮細胞は、分裂増殖することができ、またガス交換を担う1型肺胞上皮細胞に分化することができるため、肺において重要な幹細胞であると考えられています。間質性肺炎の2型肺胞上皮細胞では、細胞の老化が起きていること、また1型肺胞上皮細胞への適切な分化が障害されていることが報告されています。ブレオマイシンを投与した肺胞オルガノイド中の上皮細胞では、細胞老化のマーカーが強く発現し、球状体を形成した上皮細胞の層が肥大化していました(図2A)。次に、これらの細胞の老化や上皮細胞の分化の異常を抑制できる物質を探索しました。その結果、TGFβ注5の機能を阻害することで、細胞老化や上皮細胞の分化異常を示すマーカー遺伝子の発現が低下することが分かりました(図2B)。
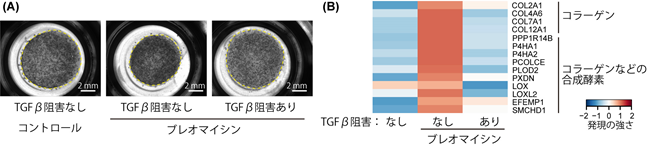
TGFβの阻害による肺胞オルガノイド中の線維芽細胞病態の改善
最後にTGFβの機能を阻害することで、ブレオマイシンを投与した肺胞オルガノイドの中の線維芽細胞においても病態の改善が認められるかを評価しました。その結果、TGFβの機能を阻害することで、ブレオマイシン投与によって小さくなった肺胞オルガノイドの培養ゲルの面積が大きくなり(図3A)、ブレオマイシン投与によって増加したコラーゲンやコラーゲンなどの合成酵素の量が減りました(図3B)。これらの結果から、TGFβの機能を阻害することで、ブレオマイシンによって起こる線維芽細胞の病態が改善することが分かりました。
今回の研究で、iPS細胞を用いて作製した肺胞オルガノイドを活用することで培養皿の中で間質性肺炎の病態を再現できること、また様々な治療薬候補物質の作用を評価することに成功しました。今後はこの試験系が新しいメカニズムを持つ間質性肺炎の治療薬の開発に役立つことが期待されます。
波及効果、今後の予定
iPS細胞を活用することで、これまでに入手・培養が難しかった肺胞上皮細胞を創薬に応用可能なレベルで入手可能になったことが、今回の研究成果につながりました。今後は今回の成果を活かして、間質性肺炎の発症メカニズムをより詳しく解析し、新しい治療薬の探索に役立てていきます。
研究プロジェクトについて
本研究は、下記機関より資金的支援を受けて実施されました。
杏林製薬株式会社、日本医療研究開発機構 再生医療実現拠点ネットワークプログラム 幹細胞・再生医学イノベーション創出プログラム「多能性幹細胞を用いたヒト由来肺組織シミュレーターの創出」、日本学術振興会・文部科学省 科学研究費補助金
用語説明
- 注1 肺胞上皮細胞
- 呼吸時の酸素の取り込みを担う肺胞の表面に存在する細胞。1型肺胞上皮細胞は、扁平な構造をとることで、効率よく酸素を取りこむことができます。2型肺胞上皮細胞は、肺サーファクタントを分泌することで呼吸時の肺胞構造の維持を行う役割と、組織幹細胞(自己増殖能と1型肺胞上皮細胞への分化能を持つ細胞)としての役割があります。
- 注2 線維芽細胞
- 様々な臓器において結合組織を構成する細胞の一つ。間質性肺炎においては、異常に活性化した線維芽細胞がコラーゲンを大量に分泌することによって、肺胞の壁が固くなり肺が収縮すると考えられています。
- 注3 オルガノイド
- 培養皿の中で幹細胞からつくられた臓器に似た立体構造体。様々な種類の細胞から構成されており、「ミニ臓器」とも呼ばれます。
- 注4 ブレオマイシン
- ヒトのがん治療に用いられる薬剤。副作用として間質性肺炎を示すことから、動物実験においては間質性肺炎を再現するための薬剤として用いられます。
- 注5 TGFβ
- 細胞の増殖や分化を調節するタンパク質。間質性肺炎の発症と病態の進行に重要な役割を果たすと考えられています。
参考文献
- Yamamoto, Y. et al. Long-term expansion of alveolar stem cells derived from human iPS cells in organoids. Nat Methods 14, 1097-1106, doi:10.1038/nmeth.4448(2017).
論文タイトルと著者
- タイトル
- Disease modeling of pulmonary fibrosis using human pluripotent stem cell-derived alveolar organoids(ヒト多能性幹細胞由来の肺胞オルガノイドを用いた肺線維症の疾患モデリング)
- 著者
- Takahiro Suezawa, Shuhei Kanagaki, Keita Moriguchi, Atsushi Masui, Kazuhisa Nakao, Masayasu Toyomoto, Koji Tamai, Ryuta Mikawa, Toyohiro Hirai, Koji Murakami, Masatoshi Hagiwara, Shimpei Gotoh
- 掲載誌
- Stem Cell Reports
- DOI
- 10.1016/j.stemcr.2021.10.015
お問い合わせ先
研究に関するお問い合わせ先
後藤慎平(ごとう しんぺい)
京都大学大学院医学研究科 呼吸器疾患創薬講座・呼吸器内科学 特定准教授
TEL:075-753-4352 FAX:075-753-4414
E-mail:gotoh.shimpei.5m“AT“kyoto-u.ac.jp
報道・取材に関するお問い合わせ
京都大学 総務部広報課国際広報室
TEL:075-753-5729 FAX:075-753-2094
E-mail:comms“AT“mail2.adm.kyoto-u.ac.jp
AMED事業に関する問い合わせ先
日本医療研究開発機構(AMED)
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課
TEL:03-6870-2220 FAX:03-6870-2242
再生医療実現拠点ネットワークプログラム
E-mail:saisei“AT“amed.go.jp
E-mailアドレスは、”AT”を”@”に変えて使ってください。
関連リンク
掲載日 令和3年11月29日
最終更新日 令和3年11月29日


