成果情報 デュシェンヌ型筋ジストロフィーにおける筋収縮力低下のメカニズムの一端を解明
成果情報
京都大学iPS細胞研究所(CiRA)
日本医療研究開発機構(AMED)
ポイント
- デュシェンヌ型筋ジストロフィー患者さん由来iPS細胞から分化させた骨格筋細胞において、ストア依存性Ca2+チャネル注1)の一つであるOrai1-STIM1複合体注2)が筋細胞へのカルシウム過剰流入注3)を制御している責任分子であることを同定した。
- 複数のOrai1-STIM1複合体阻害剤が、筋疲労に似た収縮力低下を抑制する効果を持つことを解明した。
要旨
内村智也研究員(京都大学CiRA臨床応用研究部門、T-CiRA)、櫻井英俊准教授(京都大学CiRA臨床応用研究部門、T-CiRA)らの研究グループは、デュシェンヌ型筋ジストロフィー(DMD)患者さん由来iPS細胞を用いて、ストア依存性Ca2+チャネルの一つであるOrai1-STIM1複合体が、DMDの病態の一つとされている骨格筋細胞へのカルシウム過剰流入を制御していることを見出しました。また、同グループが以前報告した収縮力低下モデルを用いて、Orai1-STIM1複合体阻害剤による筋収縮の抑制評価を行いました。結果、複数の阻害剤に収縮力低下を抑制する効果が見られました。これにより、既存薬とは異なる効能を持つ創薬開発の実現やカルシウム過剰流入による筋収縮力低下のメカニズム解明に貢献できると期待されます。
この研究成果は2021年10月31日にスイス科学誌「Biomedicines」でオンライン公開されました。
研究の背景
DMDは、ジストロフィン遺伝子の変異により筋肉にあるジストロフィンタンパク質が欠損することで発症する進行性の重篤な筋疾患で、現在治療薬は限られており根本的な治療方法は開発されていません。
DMDの治療薬としてはステロイド剤が主に使用されていますが、病気の進行を2~3年程度遅らせるのみに留まっており、根治に至る、あるいは発症そのものを抑制する治療薬の開発が切望されています。近年iPS細胞を利用したDMDの病態研究や創薬研究が活発になってきていますが、機能的な病態を再現するには至っておらず、発症の抑制を実現するうえでもよりDMD患者さんの症状を反映した病態モデルの開発が求められています。DMD患者さんにおける病態変化の一つとして、骨格筋細胞内へのカルシウム過剰流入が考えられています。
そこで本研究グループは、DMD患者さん由来iPS細胞から分化させた骨格筋細胞を用いて、カルシウム過剰流入とDMD骨格筋の機能不全の関連性に着目した研究を行いました。
研究結果
(1)DMD患者さん由来iPS細胞から分化誘導した骨格筋細胞を用いて、STIM1-Orai1複合体阻害剤がカルシウム過剰流入を抑制することを解明
本研究グループは、骨格筋細胞におけるカルシウム過剰流入を制御する分子を探索するために、DMD患者さんから樹立したiPS細胞株とそのジストロフィン遺伝子の変異を修復したコントロールiPS細胞株注4)から骨格筋細胞(それぞれDMD∆44、DMD∆44遺伝子修復細胞)を分化誘導し(図1A)、カルシウム過剰流入試験を行いました。まず、おおまかなターゲット分子を絞り込むために、様々な市販化合物を入手しそれぞれの効果を評価しました。その中で、複数のストア依存性Ca2+チャネル阻害剤が有効であることが判明しました。ストア依存性Ca2+チャネルにおいて、Orai1-STIM1複合体の機能が最も知られていることから、Orai1-STIM1複合体阻害剤を用いてカルシウム過剰流入への効果を検証しました。すると、検証した3種類の阻害剤(CM4620、GSK7975A、AnCoA4)全てにおいて、カルシウム過剰流入を抑制する効果が認められました(図1B)。
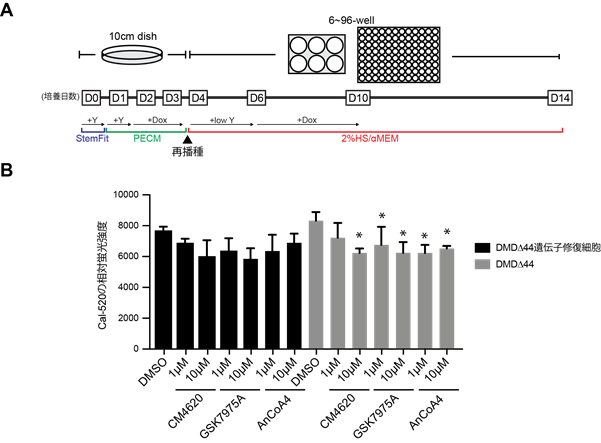
- ヒトiPS細胞からの骨格筋細胞分化誘導方法の図。iPS細胞播種4日目に再播種を行い、14日目まで分化培養を行う。
- 分化後14日目におけるカルシウム過剰流入に対する、Orai1-STIM1複合体阻害剤の効果検証実験。
- *:p値が0.05未満を統計学的に有意とみなした。DMSO:溶媒コントロール。
次に、Orai1-STIM1複合体を構成するタンパク質であるOrai1、STIM1を作るそれぞれの遺伝子が、カルシウム過剰流入を抑える上での適したターゲット遺伝子であるかを確認するために、siRNA注5)を用いた遺伝子ノックダウン注6)試験を行いました。Orai1遺伝子に対しては3種類の異なる配列を持つsiRNAを使用した一方で、STIM1遺伝子からはSTIM1LとSTIM1Sの2つのアイソフォーム注7)が生じるため、それぞれ2つと3つの異なる配列を持つsiRNAを使用しました。その結果、各siRNAはOrai1遺伝子、STIM1遺伝子のmRNA発現量を80%以上減少させました。そして、それによるカルシウム過剰流入に対する効果を検証しました。Orai1遺伝子ノックダウン試験では、3種類のsiRNA全てでカルシウム過剰流入が抑えられることが分かりました(図2A)。また、STIM1遺伝子ノックダウン試験でもSTIM1S、STIM1Lの両方でカルシウム過剰流入が減少していました(図2B)。これらの結果から、Orai1遺伝子またはSTIM1遺伝子がカルシウム過剰流入を抑えるターゲット遺伝子となり得ることが判明しました。
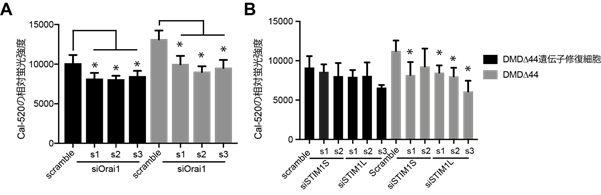
*:p値が0.05未満を統計学的に有意とみなした。
- Orai1遺伝子の発現量を減少させた時のカルシウム過剰流入量の評価。
- STIM1遺伝子の発現量を減少させた時のカルシウム過剰流入量の評価。
(2)Orai1-STIM複合体阻害剤による収縮力低下に対する効果検証実験
次に、本研究グループは筋疲労に似た収縮力低下がOrai1-STIM1複合体阻害剤により改善されるかを検証しました。図1で使用した3種類の異なるOrai1-STIM1複合体阻害剤(CM4620、AnCoA4、GSK7975A)を、長期収縮観察モデルを用いて評価しました。DMDΔ44遺伝子修復細胞に溶媒コントロールを添加すると収縮速度(=収縮力と同等)が一定の数値に保たれる(図3:青線)一方で、患者さん由来骨格筋細胞(DMDΔ44)に溶媒コントロールを添加すると、日を追うごとに徐々に収縮力が低下していきます(図3:赤線)。しかし、DMDΔ44に各Orai1-STIM1複合体阻害剤を添加すると、それぞれ収縮力低下が改善される(図3:緑線)ことが分かりました。
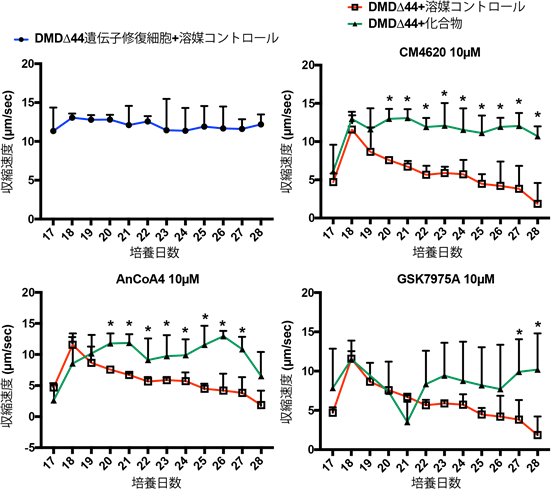
*:p値が0.05未満を統計学的に有意とみなした。
これらの結果からも、カルシウム過剰流入がDMDにおける収縮力低下の一因を担っており、Orai1-STIM1複合体がカルシウム過剰流入を制御していることが分かりました。
本研究の意義と今後の展望
DMDの患者さんは、骨格筋細胞の収縮力の低下や筋組織の破壊が顕著であり、長らくカルシウム過剰流入がそれらの原因の一つではないかと考えられてきました。しかしながら、ヒトモデルでのカルシウム過剰流入と収縮力低下の因果関係は不明のままでした。
本研究では、DMD患者さん由来iPS細胞を用い、DMD患者さんに見られるカルシウム過剰流入と収縮力低下の評価をできるモデルを活用してOrai1-STIM1複合体がカルシウム過剰流入の責任分子であることを同定し、Orai1-STIM1複合体阻害剤が収縮力低下を抑制することを明らかにしました。今後は動物試験や創薬試験を行うことで、Orai1-STIM1複合体阻害剤など筋疲労に似た収縮力低下を改善する薬剤の中から、DMDの症状改善に効果があるものを見つけることを目指します。
論文名と著者
- 論文名
- ”Orai1-STIM1 regulates increased Ca2+ mobilization, leading to contractile Duchenne muscular dystrophy phenotypes in patient-derived induced pluripotent stem cells”
- ジャーナル名
- Biomedicines
- 著者
- Tomoya Uchimura1,2* and Hidetoshi Sakurai1,2*
- 著者の所属機関
-
- 京都大学iPS細胞研究所 臨床応用研究部門
- T-CiRA プログラム
- *責任著者
本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 武田薬品工業株式会社「T-CiRA共同研究プログラム」
- 日本医療研究開発機構(AMED) 再生医療実現拠点ネットワークプログラム「疾患特異的iPS細胞の利活用促進・難病研究加速プログラム」
用語解説
- 注1)ストア依存性Ca2+チャネル
- 骨格筋の細胞内に存在する筋小胞体の中には通常多くのカルシウムが蓄えられているが、その筋小胞体の中のカルシウム濃度が低下することで活性化するチャネルの総称。
- 注2)Orai1-STIM1複合体
- ストア依存性Ca2+チャネルを代表する分子であり、STIM1がセンサーの役目を、Orai1がCa2+チャネルとしての役目を担って作用している。通常は、STIM1とOrai1は離れているが、筋小胞体からのカルシウム流出が活性化すると、両者が移動し複合体を形成することで細胞外からのカルシウム流入が起きる。
- 注3)カルシウム過剰流入
- 通常、カルシウムの細胞内への流入は過剰にならないようにしっかりと制御されているが、DMDにおけるジストロフィン欠損時では、カルシウムの流入が過剰に増加し、それにより様々な悪影響が生じることが知られている。
- 注4)コントロールiPS細胞株
- ここでは、患者さん由来iPS細胞の遺伝子変異を修復することで得られる、変異以外の遺伝的背景が患者さん由来株と同一の、コントロールとなるiPS細胞株。
- 注5)siRNA
- 21~23塩基対からなる二本鎖RNA。siRNAを細胞内に人為的に入れることで配列特異的に遺伝子の発現を抑制できる。
- 注6)ノックダウン
- 人為的にターゲット遺伝子の発現レベルを抑制すること。
- 注7)アイソフォーム
- 同一の遺伝子から作られ、それぞれのアミノ酸配列や構造的に非常に類似したタンパク質のメンバー。
お問い合わせ先
研究に関すること
京都大学iPS細胞研究所(CiRA)
研究支援部門 国際広報室
E-mail:media“AT”cira.kyoto-u.ac.jp
AMED事業に関すること
日本医療研究開発機構(AMED)
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課
TEL:03-6870-2220
E-mail:saiseinw“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和4年2月21日
最終更新日 令和4年2月21日


