成果情報 魚モデルを用いて“がん発生超初期”の新たなメカニズムを解明―前がん細胞と正常細胞の相互作用による老化誘導ががん発生を駆動する―
成果情報
大阪大学
日本医療研究開発機構
研究成果のポイント
- 患者やマウスモデルを用いた解析から、がんの発生・悪性化にかかわるメカニズムが明らかにされてきたが、がん発生超初期のメカニズムは未解明である。そこで、イメージングに適した小型魚類ゼブラフィッシュ(※1)を用いて、上皮組織に生じた“前がん細胞”(※2)の挙動を可視化解析する系を構築した。
- イメージング解析(※3)により、健康な上皮に単独遺伝子変異を持つ前がん細胞が出現すると、隣接正常細胞がその出現を感知して前がん細胞を細胞老化(増殖停止)させ、さらに、体外排出を促すことを発見した。これは免疫細胞に依らない、隣接細胞間相互作用を介したがん抑制機構である。
- 前がん細胞にがん抑制遺伝子p53の変異が追加される(二重変異細胞になる)と、隣接細胞による排除を免れて生存して炎症性サイトカインや活性酸素に放出し、隣接正常細胞に増殖と老化を誘導しながら、初期の腫瘍を形成する(がんが起こる)ことがわかった。
- ダメージ細胞(老化細胞)が蓄積した上皮では、前がん細胞の排除活性が低下しており、前がん細胞による隣接細胞を巻き込んだ腫瘍形成が起きやすいこともわかった。
- 今回発見した「がん抑制機構、がん発生機構」は、老化に起因するがん発生のメカニズムに新たな視点をもたらす重要な発見である。
概要
大阪大学微生物病研究所の石谷太教授、同大学医学系研究科博士課程の原岡由喜也氏らの研究グループは、これまで未知であった「がん発生超初期のメカニズム」の一端を明らかにしました。石谷教授らの研究グループは、従来の研究方法では解析困難であった「がん発生超初期」のメカニズムを調べるために、イメージング解析に適し、かつヒト同様の脊椎動物である小型魚類ゼブラフィッシュを用いて「生体内に生じた変異細胞(前がん細胞)の挙動を解析する系」を構築しました。この系を用いた解析により、①健康な上皮組織に単独変異を持つ前がん細胞が生じた際には、隣接正常細胞がこれを感知し細胞老化を誘導して、体外へ排除すること、②前がん細胞にp53遺伝子変異が追加された場合、あるいは上皮組織にダメージ細胞(老化様細胞)が多く存在する場合は、前がん細胞は隣接細胞による排除を受け付けずに生存し続け、逆に隣接細胞に老化と増殖を誘導して初期の腫瘍を形成することを発見しました。この成果は「ヒトのがん発生機序」や「がん発生リスクの加齢による増加」に新たな理解と視点をもたらすと期待されます。本研究成果は、2022年3月18日午後19時(日本時間)に、英国科学誌「Nature Communications」に掲載されました。
研究の背景
がん発生超初期のメカニズムは不明
がんの克服は人類の夢です。これまで数多の研究者たちによって、がんの進展・悪性化に関わる遺伝子や分子機序は数多く報告されてきました。しかしながら、これらの研究の多くは、がん発生後期の病理学的に検出可能なレベルにまで成長したがんを対象に行われたものであり、検出困難ながん発生の超初期についてはあまり研究が進んでいません。具体的には、がんはがん遺伝子やがん抑制遺伝子に変異をもった単一の異常細胞(前がん細胞)を起源として生じると考えられていますが、前がん細胞が隣接正常細胞とどのようなコミュニケーションを取りながら初期の腫瘍を形成するのかは全く不明です(図1)。また、多くの腫瘍細胞では複数の遺伝子変異が見られることから、がんは加齢に伴う遺伝子変異の蓄積の結果として生じると考えられています(図1)が、前がん細胞の挙動に遺伝子変異の追加がどのような影響を及ぼすかはよくわかっていません。
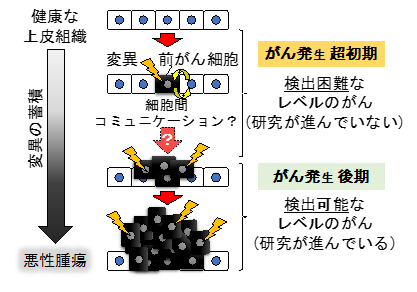
細胞老化の二面性
細胞老化とは、細胞が不可逆的に増殖停止した状態を指します。細胞老化した細胞は個体の加齢によって体内に蓄積することが知られていますが、テロメアの短縮や酸化ストレス、DNA損傷、発がんシグナルの活性化などによっても生じます。がん細胞における発がんシグナルによる細胞老化誘導には、がん細胞の増殖を停止させることで発がんを抑制する効果があると考えられています。一方で、細胞老化には発がんを促進する効果もあることが知られています。具体的には、細胞老化したがん細胞が炎症性サイトカインなどを分泌して周辺細胞に増殖を促すことなどが報告されています。しかし、細胞老化の効果が「発がん抑制」となるかあるいは「発がん促進」となるかはどのように決定されるのかは不明でした。また、組織に出現した前がん細胞の挙動と細胞老化の関連はわかっていませんでした。
研究の内容
研究者らは、従来の方法では解析困難であった「がん発生超初期」のメカニズムを調べるために、イメージングに適し、かつヒト同様の脊椎動物である小型魚類ゼブラフィッシュを用いて、「生体内に生じた変異細胞(前がん細胞)の挙動を解析する系」を構築しました。より具体的には、ゼブラフィッシュ稚魚の皮膚をヒト上皮のモデルとし、人為的に誘導した少数の前がん細胞の挙動を可視化し追跡する系を構築しました。そして、この系を用いて、代表的ながん遺伝子であるRas(※4)の異常活性化変異をもつ前がん細胞(Ras変異細胞)の挙動を解析したところ、驚くべきことに、Ras変異細胞が誘導後24時間以内に上皮組織から排除され、腫瘍が形成されないことを発見しました。さらに、排除のメカニズムを解析した結果、 Ras変異細胞に隣接する正常細胞が変異細胞に細胞老化(不可逆的増殖停止)を促すとともに、変異細胞の肥大化と細胞間接着の低下を誘導し、変異細胞を上皮から体外へ排出することを明らかにしました(図2左)。この事実は、隣接正常細胞が免疫細胞に頼らずに前がん細胞を速やかに増殖停止(細胞老化)させて体外へ排除することを示しており、細胞老化を介した新たながん抑制機構の存在を示唆しています。哺乳類培養細胞やショウジョウバエを用いた研究でも類似した機構(正常細胞-変異細胞のコミュニケーション依存的な変異細胞排除機構)が起こることが知られており、これらの現象は「細胞競合」と呼ばれ、新たな生体防御機構として近年注目されています。
また、継続的な解析により、このがん抑制機構の破綻によって初期の腫瘍形成が駆動されることを発見しました。具体的には、がん抑制遺伝子p53の機能亢進変異が追加導入されたRas変異細胞(Ras-p53二重変異細胞)は排除を回避して上皮に留まり、炎症性サイトカインや活性酸素種の分泌を介して隣接正常細胞に対して増殖と細胞老化を促すことで、周辺細胞を巻き込んだ腫瘍様細胞塊を形成することを発見しました(図2中央)。すなわち、追加変異は前がん細胞の生存を助け、周辺細胞への増殖・老化シグナルの伝播を増強することで初期の腫瘍形成を駆動することが明らかになりました。
さらに、健康な組織と、ダメージを負った組織では前がん細胞の排除活性と腫瘍形成活性に違いがあることもわかってきました。具体的には、細胞にDNA損傷(ひいては細胞老化)を引き起こす「ドキソルビシン」という薬剤に稚魚を暴露し、上皮の一部の細胞にDNA損傷(および細胞老化)を誘導し、その条件下でRas変異細胞を出現させると、Ras変異細胞は組織から排除されずに止まり、p53追加変異と同じ機序で初期の腫瘍形成を引き起こすことがわかってきました(図2右)。この事実は、損傷を負った組織(あるいは老化した細胞が多い組織)では腫瘍が形成されやすいことを示唆しています。
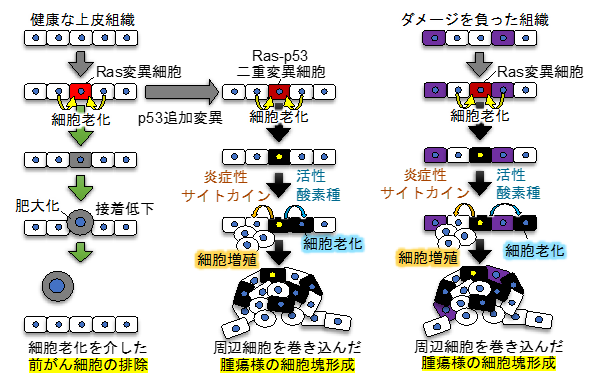
なお、本研究では、前がん細胞が初期腫瘍を形成するプロセスのみならず、前がん細胞が細胞老化するプロセス、隣接正常細胞に細胞老化を促すプロセスの脊椎動物生体内での可視化に世界で初めて成功しました。可視化により細胞の振る舞いを目で追跡することが可能になったことで、想定していなかった意外ながん制御機構が明らかになりました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究では、「細胞間コミュニケーションと細胞老化を介した前がん細胞排除機構」とその破綻による「がん発生超初期のメカニズム」を明らかにしました。また、本研究で発見した「遺伝子変異の蓄積やダメージによってがんが生じやすくなるメカニズム」は、加齢に伴う発がんリスク増加の原理の一端を説明しうると考えています。魚をモデルとした研究ですが、ヒトがん発生初期でも同様のメカニズムが働くことが予測され、本研究で見えてきたメカニズムは「がん発生を抑制、予防する新技術」へつながりうると期待しています。
また今回の発見は、がん治療の大きな障壁の一つである「腫瘍内不均一性」に、新たな理解をもたらすものでもあります。近年の研究によって、一つの腫瘍の中には異なる遺伝子変異を持つ細胞が含まれており、この不均一さのために、特定の治療薬で全てのがん細胞を駆逐するのが困難となっている、と考えられています。これまで、腫瘍内不均一性が生じるメカニズムとしては、「多様ながん細胞を生み出すがん幹細胞によるもの」といった説や、「遺伝子変異蓄積がランダムに生じた結果」といった説が考えられてきましたが、今回の発見により「前がん細胞が隣接細胞を巻き込んで不均一な細胞塊を作り出す」という、新たなモデルが提唱されました。我々の発見した現象が普遍的ながん発生制御機構であるとまでは考えていませんが、少なくとも、がんのバイオロジーに新たな視点を生み出し、かつヒトのがん発生機構の理解と治療予防戦略のシーズに繋がる成果であると考えています。
加えて本研究では、正常細胞が前がん細胞に対して積極的に細胞老化を促すことを示しました。人を含む動物においては、細胞老化した細胞(老化細胞)が組織・個体の老化の促進に関わることが知られています。一つの可能性として、個体の老化過程で生じる老化細胞も同様の細胞間相互作用を介したメカニズムによって誘導される可能性が考えられます。したがって、本成果は個体老化機構の新たな理解につながる可能性も秘めています。しかしながら、隣接正常細胞がどのようにして前がん細胞の出現を認識し、細胞老化を促すのか、その詳しいメカニズムは不明です。今後はこのメカニズムの解明を目指していきます。
特記事項
本研究成果は、英国科学誌「Nature Communications」に2022年3月18日(金)19時(日本時間)に公開されました。
- タイトル
- “Zebrafish imaging reveals TP53 mutation switching oncogene-induced senescence from suppressor to driver in primary tumorigenesis”
- 著者名
- Yukinari Haraoka1, Yuki Akieda1, Yuri Nagai1, Chihiro Mogi2, and Tohru Ishitani1,2,3
- 所属
- 1)大阪大学微生物病研究所環境応答研究部門生体統御分野、2)群馬大学生体調節研究所、3)大阪大学感染症総合教育研究拠点
なお、本研究は、日本医療研究開発機構(AMED)「老化メカニズムの解明・制御プロジェクト」、科学研究費補助金、JST次世代研究者挑戦的研究プログラム、武田科学振興財団研究助成、三菱財団、第一三共生命科学研究振興財団、上原記念生命科学財団、持田記念医学薬学振興財団などの支援を受け、実施されました。
用語説明
- ※1 ゼブラフィッシュ
- ヒマラヤ周辺の温帯地域の池の浅瀬や田んぼのそばに棲息するコイ科の淡水魚。胚や稚魚の体が小さく透明なため、イメージング解析に最も適したモデル脊椎動物であると考えられている。また、人と類似した遺伝子、細胞、臓器を有し、かつ、容易に飼育・実験操作できることなどから、「ヒト疾患研究の第3のモデル動物」として米国NIH(国立衛生研究所)に指定されている(第1、第2のモデルはマウスとラット)。
- ※2 前がん細胞
- がん関連遺伝子(がん遺伝子やがん抑制遺伝子)に変異を持つ細胞。がんは少数の前がん細胞を起源として生じると考えられているが、あくまで仮説に過ぎない。
- ※3 イメージング解析
- 生物の体内における細胞動態、細胞内の分子動態を可視化する研究方法。最も多くの情報を得ることができ、生命現象を最も効果的に理解できる方法の一つである。対象とする生物の透明度が高ければ体内深部までイメージングが可能で、かつ対象とする生物が小さければ分子動態、細胞動態、個体の変化を同時に把握できる。このため、小さく透明度の高い生物に対して極めて有効である。マウスなど大きな動物で行う場合は、臓器を取り出したりレンズを体内に入れたり、あるいは動物を殺して固定し透明化などの処理を施す必要がある。
- ※4 Ras
- ヒトのがんの約30%で変異が起きている、代表的ながん遺伝子。
お問い合わせ先
本件に関する問い合わせ先
大阪大学微生物病研究所 教授 石谷 太(いしたに とおる)
TEL/FAX:06-6879-8358
e-mail:ishitani”AT”biken.osaka-u.ac.jp
AMED事業に関する問い合わせ先
日本医療研究開発機構(AMED)
老化メカニズムの解明・制御プロジェクト
疾患基礎研究事業部 疾患基礎研究課
TEL:03-6870-2286
e-mail:aging”AT”amed.go.jp
※e-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和4年4月22日
最終更新日 令和4年4月22日


