気管支オルガノイドを用いた新型コロナウイルス研究とその創薬応用
成果情報
京都大学iPS細胞研究所(CiRA)
日本医療研究開発機構(AMED)
ポイント
- 新型コロナウイルス(SARS-CoV-2)注1)が効率よく感染する気管支オルガノイド(BO)注2)由来のモデル(BO-ALI)注3)を開発した。
- BO-ALIを用いて治療薬の評価やSARS-CoV-2の感染メカニズムを解析できる。
- SARS-CoV-2は基底細胞ではなく、線毛細胞に感染することを確認した。
- 感染せずに生き残った基底細胞は、破壊された気管支上皮細胞層の再生に寄与することを明らかにした。
要旨
新型コロナウイルス感染症(COVID-19)注4)の創薬研究に使用できる細胞モデルの開発が期待されています。SARS-CoV-2は呼吸器(気管支や肺)に感染しやすいため、佐野 絵美 研究員(CiRA増殖分化機構研究部門)、鈴木 達也 助教(大阪大学微生物病研究所)、橋本 里菜 研究員(CiRA同部門)、岡本 徹 教授(大阪大学微生物病研究所)、高山 和雄 講師(CiRA同部門)らの研究グループは、ヒト気管支モデルの開発とCOVID-19創薬への応用を行いました。本研究では、BOとBO-ALIの2種類のヒト気管支モデルを開発しました。SARS-CoV-2感染実験を行ったところ、BO-ALIの方はBOと比べて2,000倍以上感染効率が高いことを確認しました。BO-ALIを用いてレムデシビル注5)やモルヌプラビル注5)、カモスタット注6)などの抗ウイルス効果を確認することができました。オミクロン株を含む8種類のSARS-CoV-2変異株の比較解析を行ったところ、BO-ALIにおいてオミクロン株は他の変異株と比べてやや感染効率が低いことが分かりました。次に、SARS-CoV-2が感染する細胞の特定を試みたところ、ウイルスは線毛細胞に効率的に感染しますが、基底細胞にはほとんど感染しないことを見出しました。その後、ほぼすべての線毛細胞は死滅しますが、基底細胞は生存し、再び線毛細胞を含む気管支上皮細胞に分化できることを明らかにしました。基底細胞のこの再生能力は線維芽細胞増殖因子10(FGF10)注7)に依存していました。以上のことから、BOから作製したBO-ALIは、COVID-19治療薬の評価、SARS-CoV-2変異株の解析、気管支組織の再生研究に使用できることが示唆されました。
この研究成果は2022年5月30日に「Communications Biology」でオンライン公開されました。
研究の背景
大規模かつ高精度にCOVID-19創薬研究を実施するためには、ヒト呼吸器を忠実に再現したin vitro呼吸器モデルが不可欠です。BOおよび肺胞オルガノイドは、生体の呼吸器を忠実に模倣できる優れたツールであるため、COVID-19創薬研究への応用が期待されています。BOは生体の気管支と同様に、線毛細胞、クラブ細胞、ゴブレット細胞、基底細胞から構成されています。しかし、マトリゲルのようなゲルの中で培養されているBOにSARS-CoV-2を感染させても、気管支の管腔側が球体のオルガノイドの内側に沈み込んでいるため、十分な感染効率が達成できません。そこで、気液界面培養(ALI)を行うことにより、管腔側からのウイルス感染を行うことが可能になります。そこで本研究では、BOを作製したのち、BO由来のALIモデルを開発し、様々なCOVID-19創薬研究が実施できるか検討しました。
研究結果
1)BOはSARS-CoV-2にほとんど感染しない
BOを正常なヒト気管支上皮細胞注8)から分化させました。50 μLのマトリゲルの中には約100個のBOがあり、BOの直径は約100~200 μmでした(図1)。電子顕微鏡や免疫染色により、作製したBOは生体の気管支と同様に、基底細胞、線毛細胞、ゴブレット細胞、クラブ細胞で構成されていました。以上の結果から、ヒト気管支上皮細胞からBOが作製できることが分かりました。
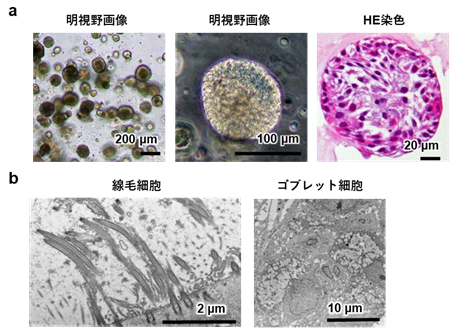
- BOの明視野画像およびHE染色画像
- BOにおける線毛細胞およびゴブレット細胞の電子顕微鏡画像
次に、BOをSARS-CoV-2に感染させたのち、5日間培養しました。球状のBOにSARS-CoV-2を感染させた場合と比べて、単細胞にまで分散させたBOにSARS-CoV-2を感染させた方が、ウイルス感染効率が高いことを確認しました(図2)。球状BOの感染効率が低いのは、SARS-CoV-2がBO内腔にある線毛細胞にアクセスできないためだと予想されます。
2)BO-ALIはSARS-CoV-2に高効率に感染する
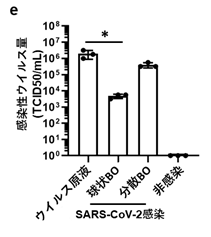
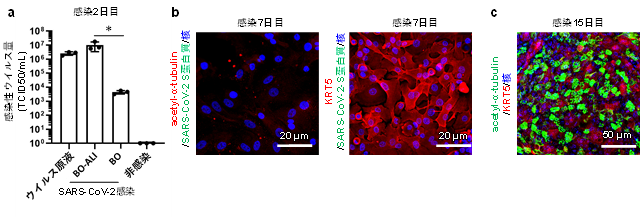
気管支の管腔側からのウイルス感染を模倣するために、気液界面培養を用いて、BOでは内側にもぐりこんでいた線毛細胞が外側に並んだ気管支オルガノイド由来の気液界面モデル(BO-ALI)を作製しました。BO-ALIおよびBOにSARS-CoV-2を感染させたのち、培養上清中の感染性ウイルス量を測定したところ、BO-ALIの方がBOよりも2,000倍ほど多いことが分かりました(図3a)。このとき、SARS-CoV-2 Sタンパク質注9)は線毛細胞のみで確認され、基底細胞ではほとんど確認されませんでした。これらの結果から、SARS-CoV-2は基底細胞よりも線毛細胞に優先的に感染することが分かりました。
ウイルス感染から1週間培養を継続すると、acetylated α-tubulin陽性線毛細胞およびSARS-CoV-2 Sタンパク質陽性細胞は観察されませんでした(図3b)。これは、ウイルス感染により線毛細胞が死滅したことを示唆しています。一方で、KRT5陽性基底細胞はウイルス感染後1週間後でも生存していました(図3b)。ウイルス感染から15日後、生き残った基底細胞はacetylated α-tubulin陽性の線毛細胞に分化し、再び気管支上皮細胞層を形成していました(図3c)。これらの結果は、ウイルス感染により破壊された気管支上皮細胞層の再生過程において、基底細胞が重要な役割を果たすことを示唆しています。
- 感染2日後のBOおよびBO-ALI培養上清中の感染性ウイルス量の比較
- 感染7日後のBO-ALIにおけるSARS-CoV-2 Sタンパク質、acetylated α-tubulin、KRT5の発現解析
- 感染15日後のBO-ALIにおけるacetylated α-tubulinおよびKRT5の発現解析 *:p<0.05の有意差を示す。
3)BO-ALIを用いたCOVID-19治療薬の評価
次に、BO-ALIを使用してCOVID-19治療薬の有効性を評価しました。感染したBO-ALIにカモスタット、レムデシビル、モルヌピラビルをそれぞれ作用させたところ、培養上清中の感染性ウイルス量の有意な減少が確認できました(図4a)。また、BO-ALIに8種類のSARS-CoV-2のバリアント(B、B.1、B.1.1.214、B.1.1.7、B.1.351、P.1、B.1.617.2、B.1.1.529)注10)を感染させると、いずれのバリアントについても培養上清中のウイルスゲノム量が経時的に増加していました(図4b)。したがって、BO-ALIは、COVID-19治療薬の有効性評価やSARS-CoV-2のバリアントごとの解析研究に使用できます。
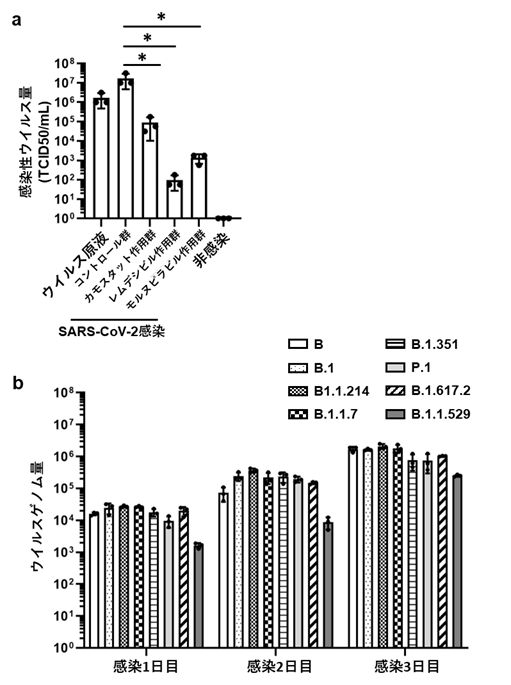
- カモスタット、レムデシビル、モルヌピラビル作用時における感染2日後のBO-ALI培養上清中の感染性ウイルス量の比較
- 8種類のバリアントのSARS-CoV-2感染時におけるBO-ALI培養上清中のウイルスゲノム量の経時的変化*:p<0.05の有意差を示す。
まとめと展望
本研究では、SARS-CoV-2研究に使用可能なBOとBO-ALIを開発しました。今回開発したBOとBO-ALIは静止した状態で培養されていますが、ヒトの体内の呼吸器は、気流によるせん断応力や呼吸による伸縮刺激に常に晒されています。せん断応力や伸縮刺激を人工的に作り出せる臓器チップ(Organs-on-a-chip)技術を用いることにより、BOやBO-ALIの機能をさらに生体に近づけることが可能だと期待されます。したがって、本研究で用いたオルガノイド技術に加えて、臓器チップ技術も用いたモデル開発を行うことで、より高度な感染症創薬が実施できるようになると想定しています。
本研究では、基底細胞がウイルス感染後の破壊された気管支上皮細胞層の再生に重要な役割を担うことを明らかにし、そのプロセスでFGF10が必須であることを確認しました。したがって、FGF10はウイルス感染によって損傷した気管支の再生に有効であることが期待されます。また、基底細胞そのものを移植することで、ウイルス感染によって損傷した気管支の再生を促進する可能性が示唆されます。しかし、FGF10や基底細胞を用いたCOVID-19の治療法を開発するためには、今後動物モデルを用いたin vivo解析も必須です。
BO-ALIを用いた検討では、気管支上皮細胞層の破壊と再生を再現できましたが、気管支炎や炎症細胞浸潤などは模倣できていません。炎症を再現するには、免疫細胞を含むモデルを新規に開発する必要があります。今後、BOやBO-ALIに加えて免疫細胞を含むモデルを構築することにより、炎症の再現および抗炎症薬の開発も可能になると期待されます。
論文名と著者
- 論文名
- “Cell response analysis in SARS-CoV-2 infected bronchial organoids”
- ジャーナル名
- Communications Biology
- 著者
- Emi Sano1**, Tatsuya Suzuki2**, Rina Hashimoto1**, Yumi Itoh2, Ayaka Sakamoto1, Yusuke Sakai3, Akatsuki Saito4, Daisuke Okuzaki5,6,7, Daisuke Motooka5, Yukiko Muramoto8, Takeshi Noda8, Tomohiko Takasaki9, Jun-Ichi Sakuragi9, Shohei Minami10, Takeshi Kobayashi10, Takuya Yamamoto1,11,12,13, Yasufumi Matsumura14, Miki Nagao14, Toru Okamoto2*, Kazuo Takayama1,13*
*:責任著者
**:共同筆頭著者 - 著者の所属機関
-
- 京都大学iPS細胞研究所(CiRA)
- 大阪大学微生物病研究所高等共創研究院
- 山口大学共同獣医学部
- 宮崎大学農学部獣医学科
- 大阪大学微生物病研究所遺伝情報実験センター
- 大阪大学免疫学フロンティア研究センターヒト免疫学(単一細胞ゲノミクス)
- 大阪大学先導的学際研究機構
- 京都大学医生物学研究所微細構造ウイルス学分野
- 神奈川県衛生研究所
- 大阪大学微生物病研究所難治感染症対策研究センターウイルス免疫分野
- 京都大学高等研究院ヒト生物学高等研究拠点
- 理化学研究所革新知能統合研究センター iPS細胞連携医学的リスク回避チーム
- 日本医療研究開発機構革新的先端研究開発支援事業(AMED-CREST)
- 京都大学大学院医学研究科臨床病態検査学
本研究への支援
本研究は、以下の支援を受けて実施されました。
- 京都大学基金 iPS細胞研究基金
- 京都大学iPS細胞研究所 山中伸弥研究室への新型コロナウイルス特別研究助成
- 京都大学ウイルス再生医科学研究所 ウイルス感染症・生命科学先端融合的共同研究拠点
- 公益財団法人 三菱財団
- 公益財団法人 千里ライフサイエンス振興財団
- 公益財団法人 アステラス病態代謝研究会
- 日本学術振興会 科学研究費助成事業 基盤研究B
- 国立研究開発法人日本医療研究開発機構(20fk0108533h0001, 21gm1610005h0001, 22gm1610005h0002)
用語説明
- 注1)SARS-CoV-2
- 新型コロナウイルス感染症を引き起こすウイルスの名称。重症急性呼吸器症候群(SARS:severe acute respiratory syndrome)コロナウイルス(CoV)の関連株。SARS-CoV-2はSタンパク質と呼ばれる突起状の構造を持つ。
- 注2)BO
- ヒト気管支と同様に、線毛細胞、基底細胞、クラブ細胞、ゴブレット細胞から構成されている。球体の構造をとっており、内腔に線毛細胞が配置されており、外側に基底細胞が配置されている。ヒト気管支を培養皿上で再現可能な三次元構造物である。
- 注3)BO-ALI
- BOをトランスウェルに播種したのち、液界面培養を行ったモデル。気液界面モデルとは細胞単層膜の上側を空気に晒して、下側を培地に接触させたもののこと。空気側に開放された方に線毛細胞が配置され、気管支内腔と同じような構造となる。
- 注4)COVID-19
- 新型コロナウイルス感染症の正式名称。CO=「corona」、VI=「virus」、D=「disease」。
- 注5)レムデシビルとモルヌプラビル
- COVID-19治療薬の一種。どちらもRNA依存性RNAポリメラーゼ(RdRp)の阻害剤である。国内でも承認され、多くのCOVID-19患者に投与されている。
- 注6)カモスタット
- II型膜貫通型セリンプロテアーゼ(TMPRSS2)の阻害剤。SARS-CoV-2は感染する際にTMPRSS2を利用するため、カモスタットを用いると細胞へのウイルスのエントリーを阻害できる。
- 注7)FGF10
- 増殖因子の一種。気管支においては、基底細胞の増殖や複製に関与することが知られている。
- 注8)ヒト気管支上皮細胞
- 気管支を構成している上皮細胞。基底細胞を豊富に含んでいる。ヒト気管支上皮細胞の凍結品が市販されている。
- 注9)SARS-CoV-2 Sタンパク質
- SARS-CoV-2粒子の表面にある突起物。ウイルスはSタンパク質を利用して、ヒト細胞のACE2に結合して感染する。
- 注10)B、B.1、B.1.1.214、B.1.1.7、B.1.351、P.1、B.1.617.2、B.1.1.529
- いずれもSARS-CoV-2変異株の一種。B.1.1.7(アルファ株)、B.1.351(ベータ株)、P.1(ガンマ株)、B.1.617.2(デルタ株)、B.1.1.529(オミクロン株)
お問い合わせ
研究内容・報道に関すること
京都大学iPS細胞研究所(CiRA)
国際広報室
和田濵
Email:media”AT”cira.kyoto-u.ac.jp
AMED事業に関すること
日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部
革新的先端研究開発課
TEL:03-6870-2224
Email:kenkyuk-ask”AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和4年6月28日
最終更新日 令和4年6月28日


