2019年度 研究事業成果集 特定の遺伝子のスイッチを操作して疾患モデル動物を作製
 遺伝子編集でさまざまな疾患への創薬に応用可能な技術を確立
遺伝子編集でさまざまな疾患への創薬に応用可能な技術を確立
群馬大学生体調節研究所ゲノム科学リソース分野の畑田出穂教授を中心とするグループは、同グループが以前に開発したエピゲノム編集法*1を応用し、特定の遺伝子のみのスイッチ(DNAメチル化)を効率的にオンにすることにより、先天性難病の一つであるシルバーラッセル症候群の疾患モデルマウスの作製に成功しました。この新たな技術は、遺伝子のスイッチの異常により発症するがんや代謝疾患、免疫疾患などの多種多様な疾患の基礎研究や創薬研究への活用が期待されます。
- *1 エピゲノム編集法
- 特定の遺伝子のエピゲノムを選択的に改変する手法です。
取り組み
双子は基本的に同じゲノムを持ちますが、病気のなりやすさが全く同じではありません。このような差が生まれる背景には、多くの遺伝子にはスイッチがあり、年齢を重ねるにつれて遺伝子のス イッチのオンとオフが異なってくるためです。つまり、遺伝子には働いているもの(オン)と働いていない状態のもの(オフ)があり、さらにどの遺伝子がオンになるかの組み合わせが個人によって 違うためです。このことは双子に限らず、すべての人間に当てはまります。そして遺伝子のスイッチをエピゲノムといい、エピゲノムにはいくつかの種類があります。そのひとつ、DNAメチル化はシトシン塩基のメチル化修飾のことであり、メチル化されている遺伝子は一般にオフになることが知られています。遺伝子のスイッチの異常は、さまざまな疾患でみられます。例えば、がんではがんを抑制する遺伝子がオフになっています。また、先天性難病の一つであるシルバーラッセル症候群では成長に関係した遺伝子のスイッチの異常で体の成長が遅れることが知られています。
CRISPR/Cas9*2ゲノム編集法という、狙った遺伝子のみを切断する技術の活用が世界的に広まりつつあり、2016年には、dCas9という切断ができない変異型Cas9酵素にエピゲノムを操作する酵素を結合させたものを用いると、標的となる遺伝子のスイッチを操作(エピゲノム編集)することができることが報告されています。
しかし、この技術は細胞レベルでの遺伝子操作はできるものの、体の中の遺伝子のスイッチを効率良く操作することはできていませんでした。
- *2 CRISPR/Cas9
- ゲノム中の特定の遺伝子のみを切断する技術の一つであり、特定の遺伝子を破壊したり改変したりすることができます。
成果
今回、エピゲノム編集法を応用し、体の中の狙った遺伝子のスイッチを効率良くオンにすることにより、シルバーラッセル症候群(以下、SRS)の疾患モデルマウスを作製することに成功しました。本研究では、以下の3通りの方法(図1)を試しました。
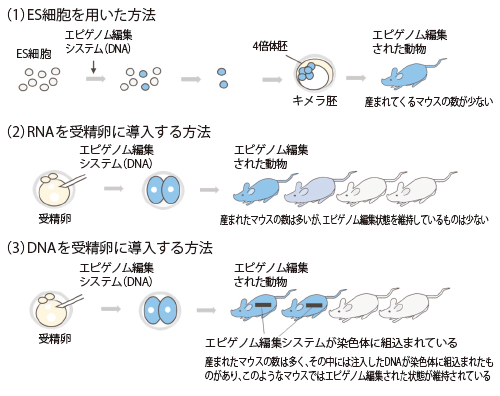
(1)ES細胞*3を用いた方法
ES細胞でエピゲノム編集を行い、SRSの原因となる遺伝子のメチル化を操作します。この方法では、エピゲノム編集を行ったES細胞に100%由来するマウスが産まれてきましたが、産まれてくるマウスの数が非常に少ないのが課題でした。
(2)RNAを受精卵に導入する方法
エピゲノム編集のシステムをRNAとして受精卵に注入し、SRSの原因となる遺伝子のメチル化の操作を行ったところ、産まれたマウスの数は多くなりましたが、エピゲノム編集された状態を維持しているマウスは少なく、多くは元に戻ってしまっていました。
(3)DNAを受精卵に導入する方法
エピゲノム編集のシステムをDNAとして受精卵に注入しSRSの原因となる遺伝子のメチル化の操作を行いました。産まれたマウスの数は多く、その中に注入したDNAが染色体に組込まれたマウスが確認できました。これらのマウスではエピゲノム編集された状態が維持されています。そこで、詳細な症状の解析を行ったところ、エピ ゲノム編集されたマウス(図2)は、胎児の発育遅延、出生後の成長障害、身体の左右非対称、頭が体の割に大きい、顔貌の異常、食欲不振、低血糖など多くの症状を示しました。このことから、この動物モデルはSRSの疾患モデルとして適当であることが確認されました。

- *3 ES細胞
- 動物の初期胚由来の細胞から作製された、あらゆる細胞に分化できる能力をもった細胞です。
展望
本技術により体の中の狙った遺伝子のみのスイッチを操作することができます。エピゲノムの異常で発症するがんや代謝疾患、免疫疾患など、さまざまな疾患のモデル動物を作製することにより、 これらの疾患の研究に役立てることができます。
最終更新日 令和3年8月13日


