2019年度 研究事業成果集 眼科手術時の視認性・操作の安全性を向上させる日本発の染色剤を世界で実用化
 透明で極めて薄い内境界膜の染色剤、米国FDA承認
透明で極めて薄い内境界膜の染色剤、米国FDA承認
九州大学の石橋達朗理事、佐賀大学の江内田寛教授を中心とする研究グループは、糖尿病網膜症や黄斑円孔などの硝子体手術時の内境界膜剥離のための内境界膜染色による術中の視認性・操作の安全性を向上させるため、染色性の高い色素ブリリアントブルーG(BBG250)の開発・国際展開を進め、2019年12月に新規医薬品として米国FDAの薬事承認を受けました。
取り組み
眼球は直径が約24mmの小さな臓器で、その手術には手術用顕微鏡を使用し、緻密で繊細な術中の操作を必要とします。その際、切除対象となる組織が術中に確実に視認されていることは、手術を安全に行う上で極めて重要です。
眼科手術の中で直接網膜を操作する硝子体手術では、網膜の内境界膜を剥離する高度な手術操作が必要な場合があります。内境界膜は平均の厚さが約2μmと極めて薄い透明な膜であるため、術中の視認性が確保できない状況では、それを剥離することは、高度な技術を要する困難な操作となります。
また、高齢化社会が進展中の日本では、白内障手術は重要な眼科医療で年間140万件の手術が行われます。白内障手術の重要なステップである水晶体前嚢切開(水晶体の前の膜を円形に切り取る手技)では、白内障の濁り具合により、手術時に水晶体前嚢がよく見えずに困難な場合があります。そのため、染色剤などを使用し、視認が極めて困難な組織を可視化することで、より確実かつ安全な手術が可能になります。
九州大学の研究グループは、手術中の視認性の問題を解決すべくより安全で有効な眼科用染色剤としてブリリアントブルーG(BBG250)を見いだし、非臨床試験および臨床研究を基盤とした研究開発を通じて、臨床のProof of Concept(POC:有効性の概念実証)を確立しました。その後、国際特許出願を行い、アカデミア発のベンチャーへのライセンスアウト(特許権使用・事業化を許可)を経て、わかもと製薬株式会社及びD.O.R.C社が日本・世界での開発を行ってきました。BBG250製剤は、まず2010年より欧州連合(EU)でILM-BLUE®という商品名で医療機器としての認証を受けました(図1)。EU主要国をはじめとする世界74か国で販売され、眼科手術の標準手技となっています。しかしながら、日本や北米への導入にあたっては、薬事規制の差異により医薬品としての開発が必要になりました。

成果
日本での承認には治験が必要とされたため、早期実用化を目指して、2014年に全国6医療機関にて医師主導治験を実施しました。内境界膜剥離が必要となる硝子体手術の適応がある患者31眼にBBG250を硝子体内に注入した結果、内境界膜の可視化に有効かつ安全であることが確認されました(図2)。
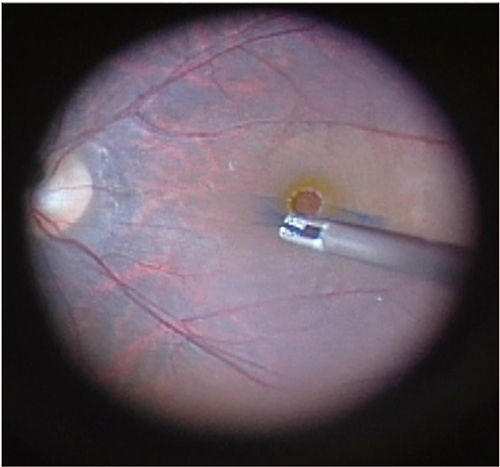
続けて、白内障手術時の前嚢染色への適応拡大を目指し、2018年に全国7医療機関にて医師主導治験を行いました。白内障手術時の水晶体前嚢染色が必要な患者30眼にBBG250を前房内に注入した結果、水晶体前嚢の可視化に有効かつ安全であることが確認されました(図3)。
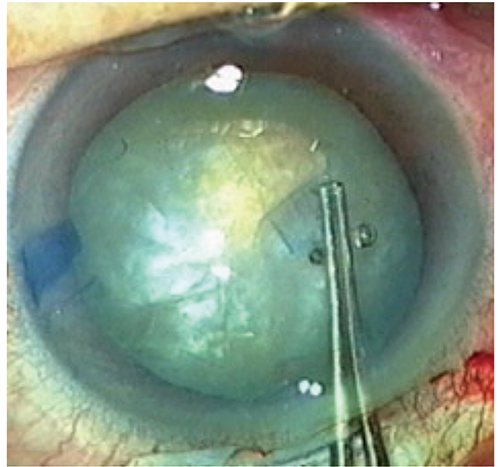
米国においては、これまでの様々な海外での臨床研究データをもとにD.O.R.C社がFDAへ承認申請を行い、2019年12月に、内境界膜剥離を適応症とする新規医薬品として承認され、2020年4月からTissueBlueTMという販売名で販売されています。
展望
日本国内では、わかもと製薬株式会社が医師主導治験2試験のデータをもとに製造販売承認の取得に向けて準備を行っており、国内においても安全な眼科手術の実現が期待されます。将来的には、この手術補助剤を全世界に普及させることによって、より多くの患者に喜ばれることを期待しています。
関連リンク
最終更新日 令和3年8月13日


