AMEDシンポジウム2019開催レポート AMEDシンポジウム2019開催レポート(2日目):招待講演②
 癌・自己免疫・老化:PD-1スイッチによる疾患制御
癌・自己免疫・老化:PD-1スイッチによる疾患制御
本庶 佑氏(京都大学高等研究院 副院長/特別教授)
はじめに

がんに対して免疫系が制御しているという概念を1970年にオーストラリアの免疫学者マクファーレン・バーネットが提唱しています。半世紀前からこうした考えがありましたがエビデンスがなく、これを実践しようという試みは、例えば、がんワクチン、Tリンパ球体外活性化法、サイトカイン療法などが何十年にわたって数え切れないほど行われましたが、玉砕しています。この理由を考えてみると、免疫系の中の負の制御分子の同定が遅れていたことが挙げられます。
PD-1の発見
我々は、胸腺における細胞選択を司る分子を探す過程で、死に至る細胞とそうでない細胞の間にcDNAのサブトラクション法で単離したPD-1(Programmed death receptor-1)という細胞膜受容体分子を見つけました。さらに研究を進めていくと、体中でTリンパ球とBリンパ球が存在し、両者が活性化されたときのみにPD-1が現れることから、未知の機能を持った重要な役割があると推測し、ノックアウトマウスによる研究を進めました。すると、PD-1に刺激を入れると免疫が過剰に高まることを見いだし、PD-1にはブレーキ(抑制)の役割があり、ブレーキを解除するとマウスの免疫系が過剰に発現して自己を攻撃することが明らかになりました。
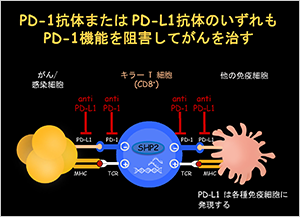
図1 PD-1抗体、PD-L1抗体のPD-1機能の阻害
画像をクリックするとPDFが開きます。
我々は、この刺激と抑制の両方のバランスをコントロールすることによって、免疫系を制御してさまざまな病気を治したいと考え、まず、PD-1が欠失したマウスとワイルドタイプを比べて、がんの増殖を見たところ有意差が認められました。ここから臨床応用を目指し抗体をつくって抗体投与によるがん細胞の増殖をマウスモデルで検証しました。その結果、腫瘍にPD-1抗体を投与しておくと増殖や転移を防ぐことができることが、2002~2003年までに得られました。
この結果を推測すると、キラーT細胞はがん細胞を殺そうとしてアタックすると、そのサイトカインなどの刺激によりがん細胞はPD-L1というPD-1のブレーキが押し込まれ、キラーT細胞はがん細胞をそれ以上殺すことができなくなり、小さながん細胞がやがて黙々と大きな腫瘍をつくっていきます。この状態で、ブレーキの押し手をレセプターであるPD-1と接触しないように抗体を再び活性化すると、レセプターリガンドがこのシグナルをブロックして活性を取り戻し、再び腫瘍を攻撃することが推測されました(図1)。
臨床治験が米国と日本で開始
これらの成果をもとに、ヒトの臨床応用を考え、ヒト抗体遺伝子を持つマウスに現在、ニボルマブと呼ばれるヒトPD-1抗体をつくり、2006年にFDA(米国食品医薬品局)から研究用新薬として承認され、米国で治験を開始しました。当時、治験に登録してくる患者はほとんどおらず、長い年月がかかりましたが、集まった終末期患者さんの20~30%に有効性が見いだされました。さらに、腫瘍の大きさが低下し治療を止めて半年くらい経過しても、再び大きくなることはなく、従来の抗がん剤治療では見られなかった効果が得られました。
そこで、我々も日本でプラチナ製剤耐性の卵巣がんに対するPD-1抗体がん治療第Ⅱ相試験を行ったところ、50%の患者さんで腫瘍の増殖が停止または縮小が見られ、さらに、現在まで6年以上、全く再発がないという結果を得ています。
その後、多くの臨床治験が報告されるようになり、13種類のがん腫に対してこのPD-1阻害療法が承認されています。
この治療法によるがん治療が、パラダイムシフトになったといわれていますが、その理由として、①正常細胞は直接影響を受けないため、直接的な副作用が少ないこと、②ほとんどの遺伝子変異のあるがん腫に適用可能であること、そして、最も大きな点として、③治療を止めても効果が長続きすることが挙げられます。
では、なぜ免疫療法がこれだけ広範ながん腫に有効性が見られたかというと、膨大な数のがんゲノムプロジェクト研究が行われ、がん細胞が大量の遺伝子変異をゲノムに蓄積して、変異(新規)抗原を発現するため、免疫細胞に異物と認識されることが明らかになったと考えられます。一方で、あまりにも多くの遺伝子変異が蓄積するため、どれが優位な変異かを決めて化学療法を行うのが困難であるという問題があります。がんは常に変異を続けていく細胞集団なので、抗がん剤に必ず抵抗性を示す細胞をつくります。したがって、今後は免疫療法を改良していくことが、がん治療の正しい道ではないかと思っています。
PD-1阻害との組み合わせによるがん免疫療法
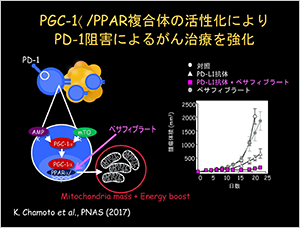
図2 PGC-1α/PPAR複合体の活性によるPD-1阻害
画像をクリックするとPDFが開きます。
PD-1阻害との組み合わせによるがん免疫療法の治療は、全世界で臨床治験が行われていますが、我々は全く違う観点からこの問題に取り組んでいます。
我々はTリンパ球の増殖スピードが大腸菌よりも早いことに注目し、ミトコンドリアを活性化するキー転写因子PPARとPD-1、PGC-1αの複合体に作用するベサフィブラートを見いだしました。これをPD-L1抗体と組み合わせると腫瘍の増殖が明らかに、より強力に抑えられることを突き止めました(図2)。
PD-1と老化
今後、医療研究の重要な要素の一つに、エイジング(老化)が挙げられます。がんは一般的に高齢の方に起こります。これはがんの発生率との因果関係があり、免疫力が弱くなるとがんの頻度が増えるえることは間違いがありません。また、がんの免疫療法も一般的に高齢者ほど効きにくいという報告がいくつかの論文で報告されています。
我々も全く同様のことをPD-1ノックアウトマウスで確認しています。PD-1ノックアウトマウスに異種抗原を加えてみると、若年のコントロール群では腫瘍の増殖は抑えられ、高齢のコントロール群では腫瘍の増殖を抑えることはできませんが、Daudiというヒト細胞を事前に免疫しておくと、免疫が活性化されて腫瘍を抑えることができました。
そこで、実際にPD-1抗体で同様の試験を行ったところ、高齢のマウスでもコントロール群に比べてヒト抗体を組み合わせた群が腫瘍の増殖抑制効果が見られました。
PD-1 抗体治療のバイオマーカーの開発
抗体の効果予想のバイオマーカーを開発する目的で二つの試みを行いました。
まず、肺がん患者さん54名[レスポンダー25名、ノンレスポンダー22名、重篤な副作用(休薬)7名]に対して、ニボルマブ投与前、2回目の投与前、3回目の投与前と3回の血液検査のデータを集め、血漿の中から247項目のメタボライトの解析、57項目の免疫学的細胞染色解析から、レスポンダーと強く相関する4つの細胞性マーカーの組み合わせを同定して効果判定に用いました。
もう一つは、PD-1阻害抗体治療の副作用をいかに防げるかということです。自己免疫は、ヒトによって標的臓器がさまざまであり、どの臓器で自己免疫反応が起こるかが分かりません。実際に、PD-1ノックアウトマウスでは、代謝物に変化が見られ、脳内の必須アミノ酸からつくられるセロトニンやドーパミンの量が変動して精神的な変化が見られることを示していました。さらに、この免疫系は腸管細菌と大きな関係がありコントロール下に置くことが必要だと考え、PD-1をブロックするだけでなく、PD-1にアゴニスティックな活性を入れるような抗体を見つけて治療すれば、バランスが取れると考え、PD-1に対する抗体を結合したところ、刺激が抑えられたことからスクリーニングを行いました。
これらの結果から、GVHD(graft-versus-host disease:移植片対宿主病)のような強い免疫反応においては、PD-1でブレーキがかかり異常増殖が止められることを見いだしました。
最後にAMEDへの改善に向けた提言をさせていただきたいと思います。
まず、シーズを生み出す基礎医学研究を重視してほしいと考えます。多くの良いシーズが生まれれば自然に応用につながると考えております。次に、企業における応用研究は企業に任せて、アカデミアにおけるシーズの研究開発に公費を提供できないでしょうか。
基本的に大企業の研究に国費の投入は避けるべきです。また分野設定が細分化されていて、まるで特定の個人を想定させるような公募は避けるべきです。
そして、提案書のボリュームが過大です。これをもっと簡素化できると考えます。さらに、審査をより学術的に行うべきだと思います。応用の可能性はシーズのクオリティによるのです。提案書の一部は英語による申請になっていますが、これを全て英語にするか、もしくは簡素化して日本語だけにするかなどを検討いただきたいと考えます。
講演動画
当日行われた講演の様子を公開しました。以下のリンクをクリックすると、動画ページへ移動します。
※動画配信は外部サービスを使用しています。
最終更新日 令和3年1月13日


