AMEDシンポジウム2019開催レポート AMEDシンポジウム2019開催レポート(2日目):AMED成果報告⑥
 脊髄損傷患者に対する新しい幹細胞製剤
脊髄損傷患者に対する新しい幹細胞製剤
本望 修氏(札幌医科大学医学部附属フロンティア医学研究所 教授)
脊髄再生医療承認までの道のり

今回、薬事承認をいただいた自己骨髄間葉系幹細胞製剤の対象疾患は、脊髄損傷の患者さんになります。この幹細胞製品は、自分の骨髄の中にある幹細胞から作製し、薬機法に基づいた薬(再生医療等製品)になります。もう一つ、特徴として、オーダーメイド医療であることが挙げられます。自分の細胞を使って、それを薬にして自分自身を治療するという、再生医療とオーダーメイド医療の組み合わせです。
骨髄由来の間葉系幹細胞の研究を進めてきた中で、動物を用いた非臨床試験では早くから神経再生における有効性が確かめられ、2013年に脊髄損傷で医師主導治験を開始しました。そして、2016年に厚生労働省(以下、「厚労省」)の「先駆け審査指定制度」の対象品目として指定されました。また、2018年には厚労省から「製造販売承認(条件及び期限付承認)」、つまり早期承認を取得しました。2019年2月には再生医療等製品として、薬として薬価基準リストに収載され、同年5月から患者さんの受け入れを開始し、同年7月には第1例目の投与が完了しています。
その後も順調に患者さんの受け入れが進んでおり、多くの患者さんに対して、この新しい再生医療を提供している状況です。薬機法とガイドライン

図1 「最適使用推進ガイドライン」(案)による施設などの要件
画像をクリックするとPDFが開きます。
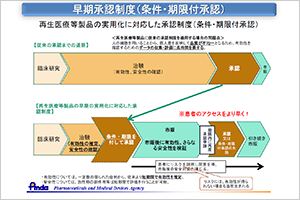
図2 早期承認制度(条件・期限付承認)
画像をクリックするとPDFが開きます。
この細胞製剤は、自分の骨髄を原材料とした再生医療等製品として、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(薬機法)で幹細胞製剤自身の安全性を検査し添付文書を作成しますが、実臨床においては特に担がん状態の方に再生医療を施すとどうなるかが現時点ではわからない部分があるため、治療法に関しては、再生医療を施す前に全身のスクリーニング検査を行い、問題がないことを確認することが重要になります。再生医療というと、ドナー細胞の安全性ばかりが注目されますが、受け手側の体の状態もとても大切です。
再生医療等製品を含めた革新的な薬に関しては、添付文書の他に厚労省の「最適使用推進ガイドライン」にも則り使用しなければなりません。その中で重要になるのが、“施設要件”と“医師の要件”です。つまり、このような最先端の再生医療は、ある程度設備の整った病院であることが条件になります。具体的には、脊髄損傷患者さんの全身管理が行えるICUを持っている、再生医療後に十分なリハビリテーションが行えるなどです。また、この再生医療を行う医師に関しても要件があり、脊髄損傷に十分な臨床経験があることなどが示されています(図1)。
今回、薬事承認が認められた早期承認制度(条件・期限付承認)は、再生医療等の製品について、有効性が推定され、安全性が確認されれば、条件・期限付きで特別に早期に承認できる制度です(図2)。承認後の市販後調査では、有効性を比較調査して証明していくことが含められています。
開発の経緯
骨髄の細胞に関しては、1990年代半ばくらいから良好な結果を得ており、1996年の論文では脊髄の脱髄領域を人工的につくって細胞を移植して再生させたことを報告しました。その後の基礎研究で、脳梗塞や脊髄損傷などの神経系の疾患は、四肢麻痺などとても重たい症状や後遺症が残ることを経験し、何とか軽減したい思いで研究を続け、2003年の段階でこの再生治療のプロトコルはできていました。当時は、このようなシステムがなかったので臨床研究に進めるのが難しい時期でした。そのときに科学技術振興機構(JST)に細胞培養施設を設置いただき、また、文部科学省(現AMED)の橋渡し研究プログラムが開始されたことでさまざまな大学・機関から支援を受けることができました。
その中で、自分自身を治療する細胞を治験薬にするため、安全性試験、品質試験、GMP製造、治験デザインと大きく4つに分けたオーダーメイド医療を構築し、医師主導治験を開始することにつながったと考えています。
講演動画
当日行われた講演の様子を公開しました。以下のリンクをクリックすると、動画ページへ移動します。
※動画配信は外部サービスを使用しています。
最終更新日 令和3年1月13日


