AMEDについて CDISC(国際的臨床試験データ標準を作成するコンソーシアム)への加盟、活動状況
CDISC入会の経緯と活動
CDISCは、データの相互利用を可能とする、国際的でプラットフォームに依存しない標準化データモデルを開発・支援することで、医学研究やヘルスケア研究を改善するために平成9年に設立された国際的・学際的なNPOです。
PMDAでは平成28年10月から、新薬の製造販売承認申請時にCDISC標準に準拠した臨床試験電子データの提出受付を開始(FDAも既に実施)しており、今後の臨床研究・治験はアカデミア主導であっても計画・実施の段階からCDISC標準対応で行うことが必須となり、早晩、出口を見据えたAMED委託臨床研究はCDISC標準対応での実施を義務化する必要が出てくるものと予想されます。
このため、AMEDも、CDISC会員となって情報を得、先導していくことは日本のアカデミア発創薬支援をはじめとする医療研究開発に資するところが大きいと考えられたため、平成28年8月4日にCDISCに入会しました。
CDISCに加盟することで、具体的に、CDISC標準に係わるトレーニングや教育を受けられる機会が増え、臨床試験実施の際のCDISC標準使用の推進・相談対応も行いやすくなりますし、CDISC Advisory Council(CAC, CDISC 諮問委員会)へ参加することで日本の声をCDISCに反映しやすくなります。
平成29年3月24日には、臨床研究に係わる研究者に、CDISC標準の重要性等をより広く知ってもらうために、AMED主催、UMIN共催でCDISC公開シンポジウムを開催しました。
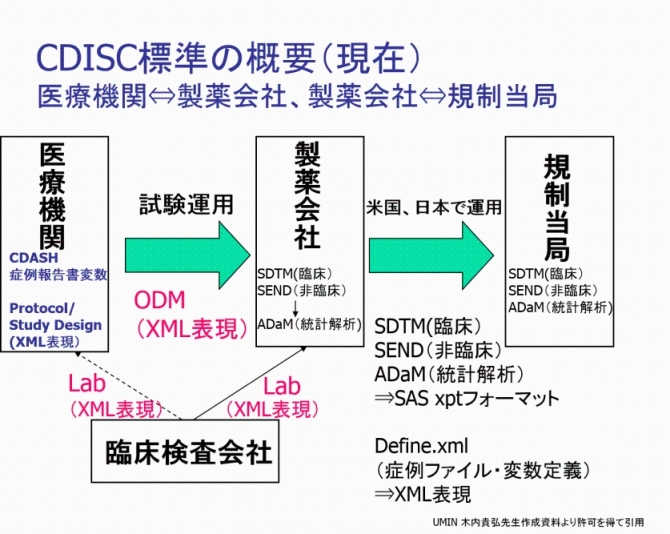
図:CDISCで定められている種々の標準フォーマット
CDISCと日本のアカデミア研究者を教育するための新規パートナーシップを締結しました
平成28年にCDISCに加盟した後、AMEDでは日本のアカデミアに所属する研究者のCDISC標準に対する理解を深めるための取組みについて、CDISCと協議を重ねてきました。
協議の結果このたびCDISCと新たにアカデミアの研究者を対象としたトレーニングを提供するためのPartnership Agreementを締結いたしましたので、報告いたします。
このパートナーシップに基づき、CDISCはAMEDが指定する研究者あるいは研究支援者等を対象とし、オンライン教育コンテンツを用いたトレーニングを提供することとなります。トレーニングを受けた研究者や研究支援者はその経験をCDISCにフィードバックすることで、CDISCが今後新しいデータ標準の作成やトレーニング、ツールの開発をする際に、日本のアカデミアの研究者のニーズに基づいた内容となるよう、反映させていくこととなります。また、日本のアカデミア研究者に標準化の概念を定着させ、臨床研究を推進し、医薬品、医療機器開発を促進することも期待しています。
なお、パートナーシップに基づき実施する活動については、詳細が決まりましたら該当する方々に改めてご案内させていただきます。
日本語訳をご覧になりたい方は以下をご覧ください。

関連リンク
掲載日 令和2年6月16日
最終更新日 令和2年6月16日


