プレスリリース なぜ私たちは眠るか―眠りの素は細胞内カルシウム?―
プレスリリース
国立大学法人東京大学
国立研究開発法人理化学研究所
国立研究開発法人日本医療研究開発機構
国立研究開発法人科学技術振興機構
研究成果のポイント
- 新規の睡眠の理論モデルに基づいてカルシウムイオン関連経路が睡眠時間に重要であることを予測し、本予測を遺伝子改変マウスと薬理実験により世界で初めて実証した。
- 新規の睡眠の理論モデルに基づいて、CaMKIIをはじめとするカルシウムイオン関連経路に含まれる7遺伝子について遺伝子を改変したマウスの睡眠時間が増減することを予測し、実験で示した。
- 睡眠障害および睡眠障害を合併するさまざまな精神疾患・神経変性疾患(統合失調症、うつ病、アルツハイマー病、パーキンソン病など)の機序の解明、新規の標的遺伝子の提案に繋がることが期待される。
発表概要
発表内容
背景
不眠や過眠などの睡眠障害は現代社会における重大な疾患の一つであり、精神疾患や神経変性疾患の重要な合併症でもあります。睡眠障害に対する診断法、治療法の開発には、睡眠覚醒のメカニズムを理解することが必要不可欠です。
睡眠はヒトを含む多種の生物で観察される基本的な生理現象であり、睡眠を制御する因子は主にハエを用いたフォワードジェネティクス(注2)による探索で、体内時計に関係した遺伝子を中心に複数特定されてきました。しかしながら、体内時計とは別の睡眠時間を直接制御している遺伝子(睡眠時間制御因子、注3)は未解明のままでした。表現型から遺伝子に遡るフォワードジェネティクスに基づいた睡眠時間制御因子の探索は、遺伝子と睡眠表現型の結びつけに多くの時間とコストを要します。更に、従来の睡眠測定は、脳波を取得するための電極を手術によって頭蓋骨に装着する必要があり、侵襲が大きく、多くの時間とコストが同様にかかります。近年、本研究グループは、遺伝子と表現型を直接結びつけることができるリバースジェネティクス(注4)に注目し、この手法を迅速に行うために、高速に遺伝子改変動物を作製することができる技術(トリプルCRISPR法、注5)を開発し、さらに、高速に睡眠表現型を解析することができる手法(SSS、注6)を開発しました。
今回、本研究グループは神経細胞のコンピュータシミュレーションにより睡眠時間制御因子を絞り込み、トリプルCRISPR法とSSSを組み合わせることで、カルシウムイオン・カルモジュリン依存性プロテアーゼⅡ(CaMKII)をはじめとするカルシウムイオン関連経路が睡眠時間制御因子の役割を担うことを明らかにしました。
研究手法と成果
- (1)コンピュータシミュレーションを用いた睡眠時間制御因子の絞り込み(図1)
- 睡眠時には余波とよばれる特徴的な脳波が観察されます。本研究グループは、徐波形成に必要な遺伝子を特定するために、平均場近似(注7)を施した神経細胞のコンピュータモデルを作製して解析しました。その結果、カルシウムイオンの流入に伴う神経細胞の過分極が徐波形成にきわめて重要であることが示され、その経路に含まれる、電位依存性カルシウムチャネル(注8)、NMDA型グルタミン酸受容体(注9)、カルシウム依存性カリウムチャネル(注10)、カルシウムポンプ(注11)が徐波形成に必要な遺伝子群として予測されました。
- (2)ノックアウトマウスを用いた睡眠時間制御因子の同定(図2)
- (1)の予測を実証するために、本研究グループは、カルシウムイオン依存的な過分極経路に含まれる遺伝子をマウスのゲノム情報をもとにすべて同定し、トリプルCRISPR法によりそれぞれのノックアウトマウスを作製し、SSS法を用いて睡眠の測定を行いました。その結果、Cacna1g, Cacna1h(電位依存性カルシウムチャネル)、Kcnn2, Kcnn3(カルシウム依存性カリウムチャネル)、Camk2a, Camk2b(カルシウムイオン・カルモジュリン依存性プロテインキナーゼⅡ)ノックアウトマウスが顕著な睡眠時間の減少を示す一方で、Atp2b3(カルシウムポンプ)ノックアウトマウスは顕著な睡眠時間の増加を示し、これらの遺伝子が睡眠時間制御因子であることが明らかとなりました。
- (3)全脳イメージングを用いた神経細胞の興奮性解析(図3)
- 本研究グループは(1)で予測されたカルシウムイオンの流入に必要なNMDA型グルタミン酸受容体を、薬理学的に阻害することで詳細な解析を行いました。その結果、マウスの睡眠時間が減少することを明らかにしました。さらにCUBIC(注12)を用いて、睡眠が減少したマウスの脳を透明化し、一細胞解像度で観察しました。その結果、NMDA受容体の阻害(すなわちカルシウムイオンの流入阻害)によって、大脳皮質の神経細胞の興奮性が上昇することを示しました。
(1)~(3)の結果から、カルシウムイオンの流入に伴う神経細胞の過分極が睡眠を誘導することを世界で初めて明らかにしました。
本研究グループは、単一の遺伝子(Kcnn2, Kcnn3, Cacna1h, Cacna1g, Atp2b3, Camk2a, Camk2b)をノックアウトすることで、安定した表現型を示す睡眠障害モデルマウスを作製することに成功しました。さらに睡眠障害と精神疾患、神経変性疾患との密接な関係から、今後、これらの睡眠障害マウスをより深く研究していくことにより、精神疾患や神経変性疾患の原因解明、治療薬探索への貢献が期待されます。
本研究は、国立研究開発法人日本医療研究開発機構革新的先端研究開発支援事業(AMED-CREST)の研究開発領域「生体恒常性維持・変容・破綻機構のネットワーク的理解に基づく最適医療実現のための技術創出」(研究開発総括:永井良三)における研究課題「睡眠・覚醒リズムをモデルとした生体の一日の動的恒常性の解明」(研究代表者:上田泰己)の一環で行われました。なお、本研究開発領域は、平成27年4月の日本医療研究開発機構の発足に伴い、国立研究開発法人科学技術振興機構から日本医療研究開発機構へと移管されています。
発表雑誌
論文タイトル:Involvement of Ca2+-dependent hyperpolarization in sleep duration in mammals.
著者:Fumiya Tatsuki, Genshiro A. Sunagawa, Shoi Shi, Etsuo A. Susaki, Hiroko Yukinaga, Dimitri Perrin, Kenta Sumiyama, Maki Ukai-Tadenuma, Hiroshi Fujishima, Rei-ichiro Ohno, Daisuke Tone, Koji L. Ode, Katsuhiko Matsumoto and Hiroki R. Ueda*
DOI番号:10.1016/j.neuron.2016.02.032
お問い合わせ先
研究に関すること
教授 上田 泰己(うえだ ひろき)
TEL:03-5841-3415
FAX:03-5841-3418
E-mail:uedah-tky“AT”umin.ac.jp
事業に関するお問い合わせ
戦略推進部 研究企画課
TEL:03-6870-2224
FAX:03-6870-2243
E-mail:kenkyuk-ask“AT”amed.go.jp
国立研究開発法人科学技術振興機構(JST)戦略研究推進部
TEL:03-3512-3524
FAX:03-3222-2064
E-mail:crest“AT”jst.go.jp
報道に関すること
東京大学 大学院医学系研究科 総務係
TEL:03-5841-3304
FAX:03-5841-8585
E-mail:ishomu“AT”m.u-tokyo.ac.jp
科学技術振興機構 広報課
TEL:03-5214-8404
FAX:03-5214-8432
E-mail:jstkoho“AT”jst.go.jp
※Eメールは上記アドレス“AT”の部分を@に変えてください。
用語解説
- (注1)カルシウムイオン・カルモジュリン依存性プロテインキナーゼⅡ(CaMKII)
- カルシウムイオンの流入に伴い活性化するリン酸化酵素、脳の多く存在し、記憶や学習に重要な役割を果たすことが知られている。
- (注2)フォワードジェネティクス
- 特定の生命現象を示す動物のゲノムの変化を詳細に調べることによって関係している遺伝子を同定していく従来の遺伝学。
- (注3)睡眠時間制御因子
- 遺伝子改変やノックアウトによって睡眠時間を変化させる遺伝子。
- (注4)リバースジェネティクス
- 特定の遺伝子を改変し、生命現象がどのように変化するか観察することで遺伝子機能を解析する手法。遺伝子から生命現象を関連付けるため、フォワードジェネティクスとは解析法が逆向きであり、リバース(=逆方向の)ジェネティクスと呼ばれるようになった。
- (注5)トリプルCRISPR法
- CRISPR法(CRISPR/Cas系を用いたゲノム編集技術の1つ)を改良し、3種類のガイドRNAを用いて、1世代目で極めて高い確率(ほぼ100%)で大量の遺伝子ノックアウトマウスを作製できる手法。
- (注6)SSS法
- Snappy Sleep Stager 法。呼吸パターンを指標として用いることで非侵襲かつ高効率に睡眠表現型解析を行う手法。
- (注7)平均場近似
- 多数の要素が相互作用しているような集団を解析するために用いられる数学的な近似手法。
- (注8)電位依存性カルシウムチャネル
- 細胞外から細胞内へカルシウムイオンを通過させるイオンチャネル。てんかんや自閉症スペクトラム障害との関連が知られている。
- (注9)NMDA型グルタミン酸受容体
- グルタミン酸受容体の1つ。シナプスの可塑性や記憶に関連する受容体として知られる。多くの精神依存性のある薬物(覚せい剤など)の作用部位としても知られ、NMDA受容体の状態を乱すことで鎮静状態や興奮状態を誘導できる。
- (注10)カルシウム依存性カリウムチャネル
- カルシウム存在下でカリウムイオンを選択的に通過させるイオンチャネル。
- (注11)カルシウムポンプ
- 細胞内から細胞外へカルシウムイオンを通過させるイオンチャネル。
- (注12)CUBIC
- Clear, Unobstructed Brain Imaging Cocktails and Computational analysisの略。2014年4月に理研の上田泰己グループディレクター、洲崎悦生 元基礎科学特別研究員(研究当時)らが発表した脳透明化と全脳イメージングのための透明化試薬(化合物の混合溶液)とコンピュータ画像解析を合わせた方法。サンプルを試薬に浸すだけの効率的で再現性の良い方法で、複数のサンプルを同等な条件で透明化することが可能。1細胞解像度の全脳蛍光イメージングと、情報科学的解析によるサンプル間のシグナル比較を実現。
添付資料
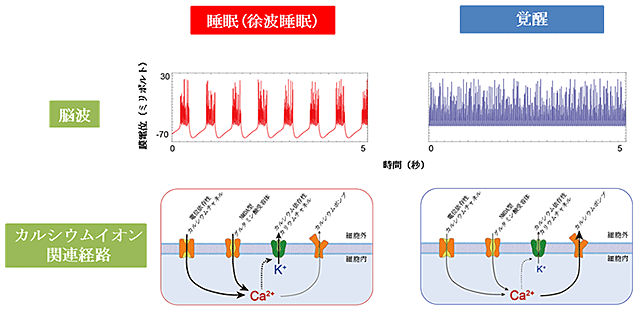
図1 睡眠時・覚醒時の脳波およびカルシウムイオン関連経路の働き
脳波が徐波を示す睡眠時は、電位依存性カルシウムチャネル、NMDA型グルタミン酸受容体を通じてカルシウムイオンが細胞内に流入し、カルシウム依存性カリウムチャネルが開きカリウムが細胞外へ流出する。一方、覚醒時はカルシウムポンプを通じてカルシウムイオンが細胞外へ流出する。
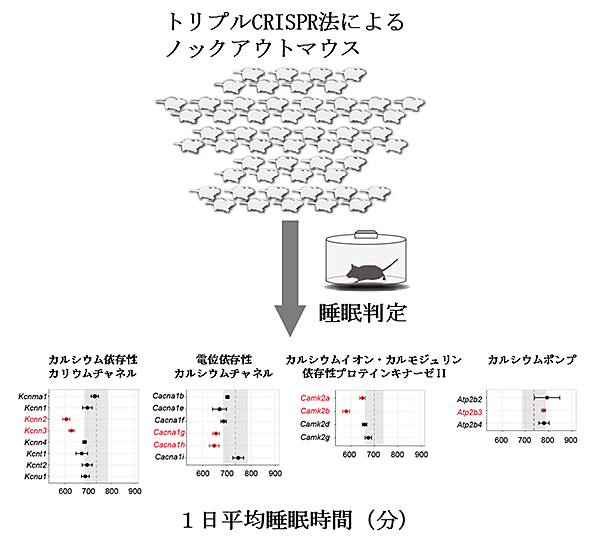
図2 Kcnn2、Kcnn3、Cacna1g、Cacna1h、Camk2a、Camk2b、Atp2b3遺伝子のノックアウトマウスにおける睡眠時間の変化
トリプルCRISPR法によってカルシウムイオン関連経路に含まれる21個の遺伝子を、それぞれノックアウトしたマウスを作製した。そのマウスにSSSを用いて睡眠解析を行ったところ、そのうちのCacna1g, Cacna1h(電位依存性カルシウムチャネル)、Kcnn2, Kcnn3(カルシウム依存性カリウムチャネル)、Camk2a, Camk2b(カルシウムイオン・カルモジュリン依存性プロテインキナーゼⅡ)をノックアウトしたマウスの睡眠時間が、野生型のマウスと比べて顕著に短いことが、Atp2b3(カルシウムポンプ)をノックアウトしたマウスの睡眠時間が、野生型のマウスと比べて顕著に長いことがわかった。グラフ中の破線は野生型マウスの睡眠時間を示す。
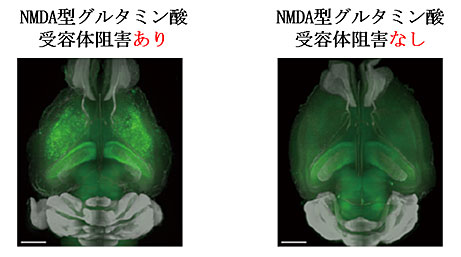
図3 NMDA型グルタミン酸受容体の阻害による神経細胞の興奮性の上昇
NMDA型グルタミン酸受容体の阻害剤をArc-dVenusマウスへ投与したところ、神経活動の上昇(緑シグナル)が観察された。
※Arc-dVenusマウス:神経細胞の活性化の指標であるArc遺伝子の発現に伴い、緑色蛍光タンパクVenusを発現する遺伝子改変マウス。
掲載日 平成28年3月18日
最終更新日 平成28年3月18日


