プレスリリース オートファジー抑制因子Rubiconが肝臓内の脂肪蓄積と肝障害を引き起こす―脂肪肝の発症メカニズムを解明―
プレスリリース
国立大学法人大阪大学
国立研究開発法人日本医療研究開発機構
研究成果のポイント
- オートファジー※1を抑制するタンパク質であるRubicon※2が高脂肪食摂取時に肝臓で増加することにより、生活習慣病である脂肪肝の病態を悪化させることを発見
- 脂肪肝の発症機序は不明であったが、Rubiconの発現上昇によるオートファジーの抑制が肝臓への脂肪沈着と肝障害を引き起こすことを解明
- 今後、Rubiconを標的とした脂肪肝に対する治療薬への応用に期待
概要
これまで脂肪肝ではオートファジー(細胞内の分解機構)が抑制されていることは報告されていましたが、その詳細については解明されていませんでした。研究グループは、高脂肪によりRubiconが肝臓で増加し、オートファジーが抑制されることで脂肪肝の病態が悪化することを解明しました。今後、Rubiconをコントロールすることで脂肪肝の治療への応用が期待されます。
本研究成果は、9月下旬以降に米国科学誌「Hepatology」にオンライン公開されます。
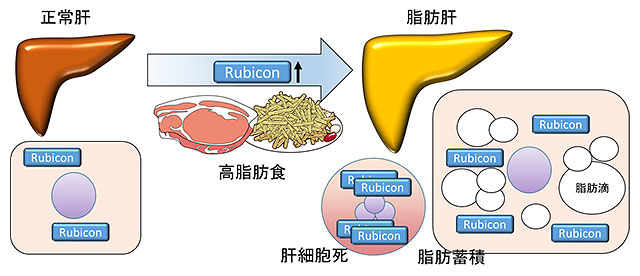 図1.脂肪肝発生のメカニズム
図1.脂肪肝発生のメカニズム脂肪食は肝細胞のRubiconを増やして脂肪分解を抑制し、細胞死を促進する。
研究の背景
過度の栄養が原因となる脂肪肝(肝細胞に脂肪が蓄積する病気)は、日本を含めた先進国で増加しており、人口の約30%が脂肪肝に罹患すると言われる程、極めて頻度の高い生活習慣病です。また、脂肪肝の一部は非アルコール性脂肪肝炎※3を経て重症化し、肝硬変、肝がんへと進行するため、脂肪肝の増悪をいかに抑制するかが課題となっています。しかし現時点では、脂肪肝を治療するための有効な薬剤は存在しておらず、病態を解明し、治療法の開発に繋げることが待ち望まれています。
これまで、脂肪肝ではオートファジー(細胞内の成分を分解する機構)が抑制されていることが報告されていましたが、その詳細については明らかではありませんでした。そこで、研究グループは、オートファジーを抑制するタンパク質であるRubiconに注目し、脂肪を与えたヒト培養肝細胞や、過栄養状態で脂肪肝を発生したマウス体内の肝細胞において、Rubiconとオートファジーや細胞死(アポトーシス)との関連を調べました。
本研究の成果
研究グループは、脂肪を与えたヒト培養肝細胞(HepG2:ヒト肝癌由来細胞)や、高脂肪食(32%脂肪含有、4ヶ月)を与えたマウスの肝細胞では、Rubiconの発現が上昇してオートファジーが抑制されることを見出しました。また、このRubiconの発現を抑える(ノックアウトする)ことにより、マウス肝臓内の脂肪蓄積と細胞死が軽減され(図2)、脂肪肝の増悪はRubiconの発現上昇を介したオートファジー機能の低下が原因で起こっていることを明らかにしました。
また、研究グループは、非アルコール性脂肪肝炎の患者さんの肝臓内でもRubiconの発現が上昇していること確認しました。
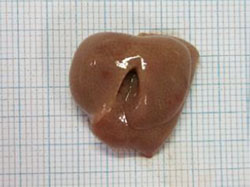
| 通常のマウス | Rubiconをノックアウトしたマウス※4 | |
|---|---|---|
| 肝臓 | 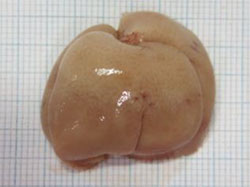 |
 |
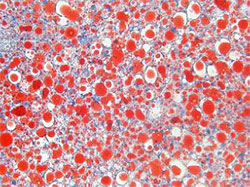
| 肝臓細胞の オイルレッド染色 |
 |
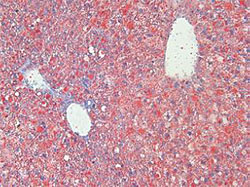 |
図2.高脂肪食を与えたマウスの肝臓および肝臓細胞の比較
Rubiconの発現を抑える(ノックアウトする)と、高栄養食により肥大化した肝臓のサイズが正常に戻り、細胞内の脂肪(下図、赤色)の蓄積が抑えられる。
本研究成果が社会に与える影響(本研究成果の意義)
また、これまでに遺伝子の突然変異によってオートファジーが低下して発症する先天性疾患(遺伝病)は複数知られていましたが、本研究は後天的な環境要因(今回は高脂肪食摂取)によってオートファジーが低下し疾患が発症することを示した初めての例です。過栄養摂取による健康障害は現代社会の最重要課題のひとつであり、その点からも注目されます。
特記事項
本研究成果は、2016年9月下旬以降に米国科学誌「Hepatology」(オンライン)に掲載されます。
- タイトル
- Rubicon inhibits autophagy and accelerates hepatocyte apoptosis and lipid accumulation in nonalcoholic fatty liver disease.
- 著者
-
Satoshi Tanaka1, Hayato Hikita1, Tomohide Tatsumi1, Ryotaro Sakamori1, Yasutoshi Nozaki1, Sadatsugu Sakane1, Yuto Shiode1, Tasuku Nakabori1, Yoshinobu Saito1, Naoki Hiramatsu1, Keisuke Tabata2, Tsuyoshi Kawabata2, Maho Hamasaki2, Hidetoshi Eguchi3, Hiroaki Nagano3, Tamotsu Yoshimori2* and Tetsuo Takehara1*
- 大阪大学 大学院医学系研究科 消化器内科学
- 大阪大学 大学院医学系研究科 遺伝学
- 大阪大学 大学院医学系研究科 消化器外科学
(*責任著者)
なお、本研究は、文部科学省科研費および国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「生体恒常性維持・変容・破綻機構のネットワーク的理解に基づく最適医療実現のための技術創出」研究開発領域(研究開発総括:永井 良三)における研究開発課題「恒常性維持機構オートファジーに着目した栄養素過剰摂取に起因する疾患の原因解明と治療法確立」(研究開発代表者:吉森 保)の一環で行われました。なお、本研究開発領域は、平成27年4月の日本医療研究開発機構の発足に伴い、国立研究開発法人科学技術振興機構(JST)より移管されたものです。
また、本研究は永野 浩昭 元・准教授(当時・大阪大学 消化器外科学、現・山口大学医学部医学科 消化器・腫瘍外科学 教授)、江口 英利 准教授(大阪大学 消化器外科学)らの協力の下に、実施されました。
用語説明
- ※1 オートファジー
-
細胞内に存在するタンパク質や構造体を二重膜で包み込み、ライソゾーム(多種の消化酵素をもつ細胞小器官)と融合することで包み込んだ内容物を分解する機構。オートファジーが開始すると、細胞質内に隔離膜が出現する。隔離膜は伸長して分解対象物を取り囲み、オートファゴソームを形成する。オートファゴソームはライソゾームと融合してオートライソゾームとなり、ライソゾーム内の消化酵素により分解対象物は分解される。
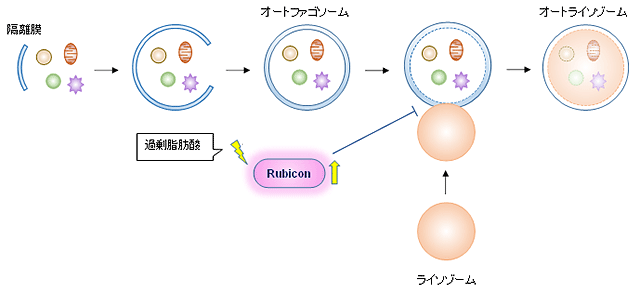
オートファジーは、細胞内の不要物を分解することにより浄化作用を持つ。近年、様々な疾患においてオートファジーの機能が低下していることが確認されており、細胞内浄化作用が抑制され細胞内に不要物が溜まることが疾患の発症につながる可能性が考えられている。
本研究では、過剰脂肪酸摂取下でRubicon蛋白が蓄積し、オートファゴソームとライソゾームの融合が阻害され、オートファジー機能が低下することが分かった。
- ※2 Rubicon(ルビコン; Run domain Beclin-1 interacting And cysteine-rich containing protein)
-
本研究グループの吉森教授らにより2009年に発見された、オートファジーを抑制する働きを持つタンパク質。オートファジーの最終ステップであるオートファゴソームとライソゾームの融合を抑制し、細胞内のRubiconが増加するとオートファジー機能が低下することが知られている。
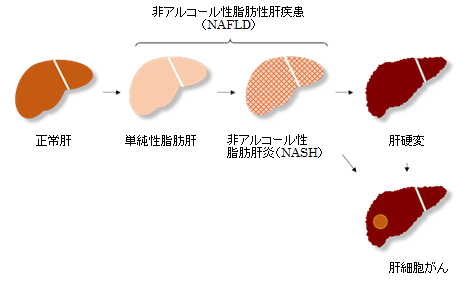
- ※3 非アルコール性脂肪肝炎(Non-alcoholic steatohepatitis:NASH)
-
脂肪性肝疾患とは、肝細胞に脂肪(中性脂肪)が沈着して肝障害を引き起こす病態の総称。明らかな飲酒歴がない(エタノール換算摂取量男性30g、女性20g/日未満)脂肪性肝疾患を、非アルコール性脂肪性肝疾患(Non-alcoholic fatty liver disease:NAFLD)と言う。近年、NAFLDは最も多くみられる慢性肝疾患であり、先進国では人口の約30%が罹患し増加傾向にある。NAFLDは、予後良好な単純性脂肪肝と進行性の非アルコール性脂肪肝炎(NASH)に分かれる。NASHはNAFLD全体の10~20%を占め、肝臓の脂肪化に加えて炎症や線維化を伴い、進行すると肝硬変や肝細胞がんに至る。
- ※4 ノックアウトマウス
-
特定の遺伝子の発現が起こらないように遺伝子操作して作製された遺伝子組換えマウス。
本件に関する問い合わせ先
研究に関すること
竹原 徹郎(たけはら てつお)
大阪大学 大学院医学系研究科 消化器内科学 教授
TEL:06-6879-3621 FAX:06-6879-3629
E-mail:[email protected]
吉森 保(よしもり たもつ)
大阪大学 大学院医学系研究科 遺伝学/生命機能研究科 細胞内膜動態学 教授
TEL:06-6879-3588 FAX:06-6879-3589
E-mail:tamyoshi“AT”fbs.osaka-u.ac.jp
報道に関すること
大阪大学 大学院医学系研究科 広報室
TEL:06-6879-3388 FAX:06-6879-3399
E-mail:kouhousitsu“AT”office.med.osaka-u.ac.jp
AMEDに関すること
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 研究企画課
TEL:03-6870-2224 FAX:03-6870-2243
E-mail:kenkyuk-ask“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
研究者のコメント
- 吉森教授
- オートファジーを抑制するタンパク質としてRubiconを発見してから、このタンパク質と病気との関係に興味を持ち研究してきました。今回の成果はRubiconが原因となっている病気の初めての報告となります。オートファジー不全を伴う疾患は脂肪肝以外にもたくさん報告されています。この中にも実はRubiconが原因となる病気があるかもしれません。
- 竹原教授
- 肝臓における細胞死の持続が肝臓における線維化・発がんを起こすことを証明してきました。肝細胞死の機序を解明することは慢性肝疾患の進行を抑えるためのキーになります。今回、Rubiconによるオートファジーの抑制が脂肪肝における肝細胞死の進行に関与していることが明らかになりました。また同時に脂肪代謝に影響し、脂肪肝の成立そのものにも関与していることが示されました。今回の研究成果を、最も頻度の高い肝疾患である脂肪肝の治療に繋げていきたいと考えています。
- 田中大学院生
- これまでオートファジーの機能低下が、遺伝病などの稀な疾患の病態形成に関わることは示されていましたが、近年患者数が増加している非アルコール性脂肪性肝疾患(NAFLD)の病態形成に寄与することが示せました。更に分子メカニズムの観点から、本学吉森保教授が発見されたRubiconタンパク質が重要な役割を果たすことを発見しました。未だ効果的な治療薬のない非アルコール性脂肪肝炎(NASH)の新規治療薬開発に繋げたいと思います。
掲載日 平成28年9月13日
最終更新日 平成28年9月13日


