プレスリリース 心不全の新たな発症メカニズム解明と新規遺伝子治療法の開発
プレスリリース
国立大学法人熊本大学
国立研究開発法人日本医療研究開発機構
概要説明
医学・医療技術の目覚ましい進歩にもかかわらず、心不全は未だ予後不良の病気です。また、超高齢社会の到来などの要因により、心不全患者数は増加しており、今後もさらなる患者数の増加が予測されます。心不全は健康長寿社会実現の大きな阻害要因になることからも、効果的な新規治療戦略の開発が望まれています。
今回、熊本大学大学院生命科学研究部の尾池雄一教授らの研究グループは、老化した細胞や様々なストレスを受けた細胞から過剰に分泌されるタンパク質である「アンジオポエチン様タンパク質2(ANGPTL2)注1)」が、心筋細胞内のカルシウム濃度調節やエネルギー産生機能を減弱させることで心筋の収縮力低下を引き起こし、心不全の発症・進展を促進することを明らかにしました。
今後、心臓から産生・分泌されるANGPTL2の働きを抑制する遺伝子治療が、心不全に対する新規治療法となることが期待されます。
本研究成果は科研費、AMED-CRESTの支援を受けたもので、平成28年9月28日10時BST(日本時間平成28年9月28日18時)に、英国のNature系科学誌「Nature Communications」オンライン版に掲載されました。
ポイント
- 加齢や高血圧などの圧負荷によるストレスを受けた心筋細胞、心不全患者の心筋細胞において、ANGPTL2の産生・分泌が増大することを発見した。
- 心筋細胞から分泌されたANGPTL2は、心筋細胞自身に作用し、心筋細胞内のカルシウム濃度調節やエネルギー産生機能を減弱させることで心筋の収縮力低下を引き起こし、心不全の発症・進展を促進することを明らかにした。
- 心筋細胞でのANGPTL2の産生増加を抑制することで、心筋細胞内のカルシウム濃度調節やエネルギー産生機能を促進し、心不全病態の進行を抑制することに成功した。
- 心不全は様々な原因からなる症候群であり、従来の治療の多くは対症療法の域を超えない。今回開発した心筋細胞でのANGPTL2産生増加を抑制する遺伝子治療法は、心機能低下のメカニズムそのものにアプローチする根本治療を目指す新規心不全治療戦略として期待される。
研究の背景と経緯
研究の成果
熊本大学大学院生命科学研究部の尾池雄一教授らの研究グループは、これまでの研究において、分泌タンパク質であるアンジオポエチン様タンパク質2(ANGPTL2)が、老化した細胞や様々なストレスを受けた細胞から過剰に分泌され、持続的な炎症(慢性炎症)を引き起こすことで動脈硬化性疾患、肥満症、糖尿病等の生活習慣病やがんの発症・進展を促進することを明らかにしてきました。今回、新たに以下のような機能によりANGPTL2が心不全の発症・進展を促進している事を明らかにしました。
- ➀ストレスを受けた心筋細胞でのANGPTL2の産生・分泌の増大
-
加齢により老化した心筋細胞や高血圧などの圧負荷によるストレスを受けた心筋細胞、心不全患者の心筋細胞では、ANGPTL2の産生・分泌が増大していることを発見しました。
- ➁ANGPTL2による心筋細胞のカルシウム濃度調節やエネルギー産生機能の低下および心不全発症・進展の促進
-
心筋細胞から過剰に分泌されたANGPTL2が心筋細胞自身に作用することで、心筋細胞内のカルシウム濃度調節やエネルギー産生といった心筋の収縮力を維持するうえで重要な機能を低下させ、心不全発症・進展を促進することを明らかにしました(図1)。
- ➂適度な運動による心筋細胞でのANGPTL2の産生量の減少
-
適度な運動は、心筋のポンプ機能促進により心不全発症に保護的作用をもたらすことがこれまで知られていました。今回、運動によって心筋細胞でのANGPTL2産生量が減少することを発見しました。
- ➃マウス心筋細胞におけるANGPTL2産生増加の抑制をもとにした心不全の新規治療法の開発
-
人為的な圧負荷によって心不全の発症を誘導すると、通常のマウスは心不全を発症するのに対し、ANGPTL2を作り出せないようAngptl2遺伝子を欠損させた遺伝子改変マウス(Angptl2ノックアウトマウス)では、適度な運動を行った場合の心臓と同様に、心不全の発症が抑制され保護的作用をもたらすことを明らかにしました。
さらに、ANGPTL2の産生を減少させる作用をもった特殊なRNA分子(short hairpin RNA, shRNA)注2)を産生できる病原性のないウイルス(アデノ随伴ウイルス)注3)を遺伝子操作により作製し、このウイルスを心筋細胞に感染させることでANGPTL2の産生を抑制する遺伝子治療法を開発しました。実際に、心不全モデルマウスでこの遺伝子治療を行ったところ、心筋細胞におけるANGPTL2産生量の増加が抑制され、心臓のポンプ機能低下が抑制されるなど心不全病態の進行を抑制することに成功しました(図2)。
- ➄ヒト心筋細胞におけるANGPTL2産生抑制によるカルシウム濃度調節やエネルギー産生機能増進の可能性
-
ヒトiPS細胞注4)から分化誘導した心筋細胞においても、ANGPTL2産生を抑制することがカルシウム濃度調節やエネルギー産生機能の増進につながることを明らかにしており、ヒト心不全患者に対してもANGPTL2産生を抑制する遺伝子治療が有効である可能性が考えられます。
以上の結果から、心不全発症の原因となる加齢や高血圧などの圧負荷によるストレスを受けた心筋細胞から過剰に産生されたANGPTL2が、これまでの慢性炎症の誘導とは全く異なるメカニズムで心不全の発症・進展を促進すること、心筋細胞におけるANGPTL2の産生増加を抑制することが心不全の新たな治療法となることが明らかになりました。
今後の展開
現在、心不全治療は対症療法が主ですが、心筋細胞でのANGPTL2産生増加を抑制する遺伝子治療は、心機能低下のメカニズムそのものにアプローチする根本治療としての新規心不全治療戦略として期待できるだけでなく、健康長寿社会の実現にも貢献することが期待されます。
用語解説
- 注1)アンジオポエチン様タンパク質2(Angiopoietin-like protein 2, ANGPTL2)
- アンジオポエチン様タンパク質は血管新生因子であるアンジオポエチンに構造上類似する分泌型タンパク質として同定され、現在8種類存在します。ANGPTL2は、そのファミリメンバーの一つです。尾池教授らにより、肥満症、糖尿病、動脈硬化性疾患などの生活習慣病やがんの発症や進展に関わることが明らかとなっており、ANGPTL2の量や作用を抑えることによって新たな生活習慣病やがんの治療薬開発に繋がるものと期待されています。
- 注2)shRNA(short hairpin RNA)
- shRNAは、標的とする遺伝子からタンパク質が合成されるのを抑制する際に利用される、ヘアピン型の構造をもつ小さなRNA分子です。このshRNAの配列の一部を標的とする遺伝子の配列と同じ配列になるように設計することで、標的遺伝子のタンパク質合成を阻害することができます。
- 注3)アデノ随伴ウイルス
- アデノ随伴ウイルスは、ヒトやマウスなどの動物に感染する小型のウイルスで、現在のところ病原性は確認されていません。アデノ随伴ウイルスには様々なタイプがあり、それぞれのタイプによって感染できる細胞の種類が異なっています。宿主となる細胞の種類にあったタイプのウイルスに目的の遺伝子を組み込み、宿主細胞に感染させることで、宿主細胞内に目的の遺伝子を送り込むことができます。このような特徴から、アデノ随伴ウイルスを用いた遺伝子治療の臨床試験などもすでに行われています。
- 注4)iPS細胞(人工多能性幹細胞)
- 皮膚などの体細胞に数種類の遺伝子を導入することで作製され、心筋や神経など様々な細胞に分化誘導することが可能な多能性をもつ細胞です。近年、再生医療や創薬への応用が大変注目されています。
付記
本研究は、以下の支援を受けて実施したものです。
- 文部科学省科学研究費補助金
-
- 基盤研究(B)「心臓リモデリングとその変容による心不全発症・進展の分子機構解明」(研究代表者:尾池雄一)
- 挑戦的萌芽研究「エピゲノム制御の観点から心不全病態分子基盤解明に挑む」(研究代表者:尾池雄一)
- 新学術領域研究(研究領域:ステムセルエイジングから解明する疾患原理)「免疫老化と幹細胞制御機構変容との連関解明」(研究代表者:尾池雄一)
- 基盤研究(C)「マイクロRNAによる心不全病態形成の分子機構解明」(研究代表者:宮田敬士)
- 若手研究(B)「DNA損傷応答因子による心不全病態形成の分子機構解明」(研究代表者:田哲)
- 国立研究開発法人日本医療研究開発機構(AMED)
-
- 革新的先端研究開発支援事業(AMED-CREST)「生体恒常性維持・変容・破綻機構のネットワーク的理解に基づく最適医療実現のための技術創出」研究開発領域(研究開発総括:永井 良三)における研究開発課題「組織修復に基づく恒常性維持機構の変容による生活習慣病の病態解明と制御」(研究開発代表者:尾池 雄一)
※なお、本研究開発領域は、平成27年4月の日本医療研究開発機構の発足に伴い、国立研究開発法人科学技術振興機構(JST)より移管されたものです。
- 革新的先端研究開発支援事業(AMED-CREST)「生体恒常性維持・変容・破綻機構のネットワーク的理解に基づく最適医療実現のための技術創出」研究開発領域(研究開発総括:永井 良三)における研究開発課題「組織修復に基づく恒常性維持機構の変容による生活習慣病の病態解明と制御」(研究開発代表者:尾池 雄一)
本研究の成果は、福島 弘之 研究員、山下 潤 教授(京都大学iPS細胞研究所)、遠山 周吾 助教、佐野 元昭 准教授、福田 恵一 教授(慶應義塾大学医学部)、氏原 嘉洋 助教、毛利 聡 教授(川崎医科大学生理学1)、奥村 貴裕 助教、室原 豊明 教授(名古屋大学大学院医学研究科)、山口 哲志 医師、和田 淳 教授(岡山大学医歯薬学総合研究科)、大津 欣也 教授(King's College London)、真鍋 一郎 教授(千葉大学大学院医学研究院)らとの共同研究によって得られました。
発表雑誌
- 雑誌名:
- Nature Communications(Article)(2016年9月28日オンライン版)
- 論文タイトル:
- ANGPTL2 Activity in Cardiac Pathologies Accelerates Heart Failure by Perturbing Cardiac Function and Energy Metabolism
- 著者:
- Zhe Tian†, Keishi Miyata†, Tsuyoshi Kadomatsu†, Haruki Horiguchi, Hiroyuki Fukushima, Shugo Tohyama, Yoshihiro Ujihara, Takahiro Okumura, Satoshi Yamaguchi, Jiabin Zhao, Motoyoshi Endo, Jun Morinaga, Michio Sato, Taichi Sugizaki, Shunshun Zhu, Kazutoyo Terada, Hisashi Sakaguchi, Yoshihiro Komohara, Motohiro Takeya, Naoki Takeda, Kimi Araki, Ichiro Manabe, Keiichi Fukuda, Kinya Otsu, Jun Wada, Toyoaki Murohara, Satoshi Mohri, Jun K Yamashita, Motoaki Sano, & Yuichi Oike*(*Corresponding author, †co-first authors)
- DOI番号:
- 10.1038/NCOMMS13016
お問い合わせ先
研究に関すること
熊本大学大学院生命科学研究部
分子遺伝学分野
担当:教授 尾池 雄一
TEL:096-373-5140
E-mail:oike“AT”gpo.kumamoto-u.ac.jp
AMEDに関すること
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 研究企画課
TEL:03-6870-2224
FAX:03-6870-2243
E-mail:kenkyuk-ask“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
添付資料
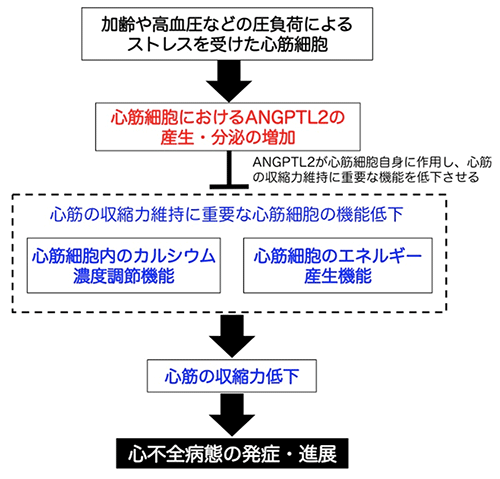
図1. ANGPTL2による心不全の発症・進展のメカニズム
心不全発症の原因となる加齢や高血圧などの圧負荷によるストレスを受けた心筋細胞では、ANGPTL2の産生・分泌が増加します。心筋細胞から過剰に分泌されたANGPTL2は、心筋細胞自身に作用することで、心筋細胞内のカルシウム濃度調節やエネルギー産生といった心筋の収縮力を維持するうえで重要な機能を低下させ、心不全発症・進展を促進します。
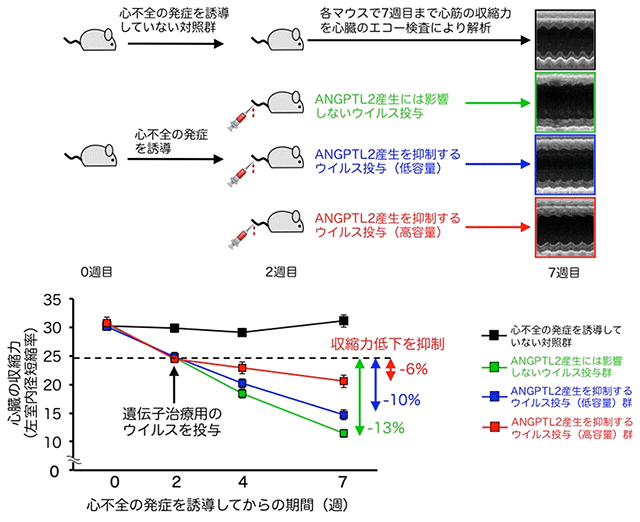
図2. 心不全の発症を誘導したマウスの心筋の収縮力の変化とANGPTL2産生増加を抑制する遺伝子治療の効果
心筋細胞におけるANGPTL2の産生を抑制する遺伝子治療法を開発し、心不全モデルマウスに対してこの遺伝子治療を行うことでその効果を心臓のエコー検査により検討しました。ANGPTL2産生に影響しないウイルスを投与したマウス(a;緑色)では、ウイルス投与後からの心臓の収縮力が13%低下していました。一方で、ANGPTL2産生を抑制するウイルスを投与したマウスでは(b;青またはc;赤色)、収縮力の低下が抑制されており、特に高容量のウイルスを投与したマウス(c;赤色)で低下率が6%と低く、心臓の収縮力が保たれていることが明らかになりました。これらの結果から、ANGPTL2の産生を抑制する遺伝子治療が心不全に対する新規治療法となることが期待されます。
掲載日 平成28年9月28日
最終更新日 平成28年9月28日


