プレスリリース 患者さん由来iPS細胞とゲノム編集技術を用いて、認知症・パーキンソニズムを来す前頭側頭葉変性症のメカニズムの一端を解明
プレスリリース
京都大学iPS細胞研究所(CiRA)
国立研究開発法人量子科学技術研究開発機構
国立研究開発法人日本医療研究開発機構
ポイント
- 前頭側頭葉変性症注1は、その一部はタウ遺伝子変異により起こる家族性の神経変性疾患注2で、そのメカニズムは詳しく知られていない。
- 患者さん由来神経細胞では、異常に折りたたまれたタウタンパク質注3が蓄積している。
- カルシウムイオンの神経細胞内への流入が前頭側頭葉変性症の神経変性に関与する。
- Designer Receptors Exclusively Activated by Designer Drugs (DREADD) 注4を患者さん由来iPS細胞に導入することによりデザイナーiPS細胞を作製し、神経変性のメカニズムの一端を解明した。
1.要旨
今村恵子特定拠点助教および井上治久教授(京都大学CiRA増殖分化機構研究部門)らの研究グループは、国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫)放射線医学総合研究所の研究グループらとともに、前頭側頭葉変性症患者さん由来の疾患特異的iPS細胞とゲノム編集技術を用いることで、神経変性疾患の1つである前頭側頭葉変性症の病態を細胞レベルで再現することに成功しました。それにより、これまで不明であった前頭側頭葉変性症のメカニズムの一端を明らかにしました。
前頭側頭葉変性症は、タウタンパク質を作るタウ遺伝子の傷(変異)により起きる、家族性の神経変性疾患です。本研究では、2人の前頭側頭葉変性症患者さんから作製したiPS細胞、遺伝子変異を修復したiPS細胞と健常者から作製したiPS細胞(対照群)にNeurogenin2という転写因子注5を加えて大脳皮質神経細胞へと変化(分化)させました。すると、患者さん由来細胞と対照群との間で、神経細胞への分化のしやすさや神経細胞を示す指標となるタンパク質の発現に差はなかったものの、患者さん由来神経細胞では異常に折りたたまれたタウタンパク質が蓄積していました。また、神経活動を人工的に調節できるDREADDというシステムを利用して、神経細胞間での情報伝達に重要な役割を果たすカルシウムイオンの細胞内への異常な流入が、異常に折りたたまれたタウタンパク質の蓄積や神経細胞の変性に関与するというメカニズムを明らかにしました。今後、このモデルを用いたさらなる病態の理解と、新薬の開発に繋がることが期待されます。また、タウタンパク質はアルツハイマー病をはじめとする様々な神経変性疾患の病態に関与していることが知られており、本研究はそれらの疾患の理解に向けた研究へも応用できると考えられます。
この研究成果は2016年10月10日(英国時間)に英国科学誌「Scientific Reports」でオンライン公開されます。
2.研究の背景
昨今、人々の寿命が延びる一方で、遅発性の神経変性疾患の患者さんは劇的に増えており、神経変性疾患の社会的負担は大きくなっています。神経変性疾患の多くは、タンパク質が異常に折りたたまれることによると報告されていますが、その一つに、前頭側頭葉変性症(FTLD)があります。FTLDの一部は、タウタンパク質を作るタウ遺伝子の変異により発症する家族性疾患(FTLD-Tau)で、脳の前頭葉と側頭葉の神経が変性することにより萎縮し、認知症やパーキンソニズム注6を呈します。
これまでiPS細胞を用いて、FTLD-Tauを含む神経変性疾患の病態が調べられてきましたが、FTLD-Tauのメカニズムについて、詳細はまだ明らかになっていません。そこで、井上教授らの研究グループは、患者さん由来のiPS細胞から大脳皮質神経細胞へと分化させることで、病態を再現するとともに、DREADDと呼ばれる人工的なデザイナー受容体を用いて、FTLD-Tauのメカニズムを検証しました。
3.研究結果
1)FTLD-Tau神経細胞では、異常に折りたたまれたタウタンパク質が蓄積する
まず、グループは、それぞれタウ遺伝子のイントロン注7とエクソン注8に変異をもち、前頭葉側頭葉認知症を患う2名のFTLD-Tau患者さんの皮膚細胞あるいは血液細胞からiPS細胞を作製しました。その際、イントロン変異をもつ患者さん由来のiPS細胞において、CRIPR-Cas9というゲノム編集技術を用いて変異を修復したiPS細胞も作製しました。iPS細胞を、Neurogenin2という転写因子を加えて大脳皮質神経細胞へと分化させました。すると、イントロン変異をもつ神経細胞では、変異を修復した神経細胞と比較し、3リピートタウよりも4リピートタウの発現が増加していました。3リピートタウと4リピートタウの割合が不均衡になると、神経変性を引き起こすと考えられています。
また、イントロン変異、エクソン変異をもつ双方の神経細胞において、細胞内で異常に折りたたまれたタウタンパク質が点状などの形態で蓄積していることが分かりました。一方、変異を修復した神経細胞を含む対照群では、異常に折りたたまれたタウタンパク質はほとんど見られませんでした。
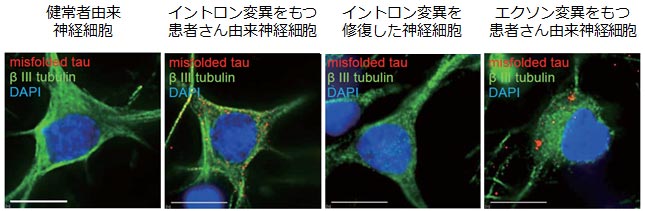 図1. 患者さん由来神経細胞内に蓄積した異常に折りたたまれたタウタンパク質
図1. 患者さん由来神経細胞内に蓄積した異常に折りたたまれたタウタンパク質
(スケールバー:10µm)
イントロン変異、エクソン変異をもつ神経細胞では、対照群と比較し、分子量の大きいタウタンパク質が蓄積していましたが、その差は変異により異なり、異常に折りたたまれたタウタンパク質の形態は一様でないことが示唆されました。また、異常に折りたたまれたタウタンパク質は細胞外にも放出されていました。
2)FTLD-Tau神経細胞では、神経活動に伴う神経細胞内カルシウムイオンの増加率が上昇する
神経細胞間の情報伝達では、カルシウムイオン(Ca2+)が重要な働きを果たしています。カルシウムイオンが神経細胞内に流入することで、神経伝達物質が細胞上の受容体に結合し、情報が伝達されます。そこで、グループは、作製した神経細胞でのカルシウムイオンの動態を検証しました。神経細胞に電気刺激を与えると細胞内のカルシウムイオン濃度が上昇しますが、その増加率は対照群と比較し、患者さん由来神経細胞では異常に高いことが分かりました。この結果より、FTLD-Tau神経細胞では、その興奮性が上昇していることが示唆されました。
また、FTLD神経細胞は対照群よりも細胞死を引き起こしやすいことが分かりました。
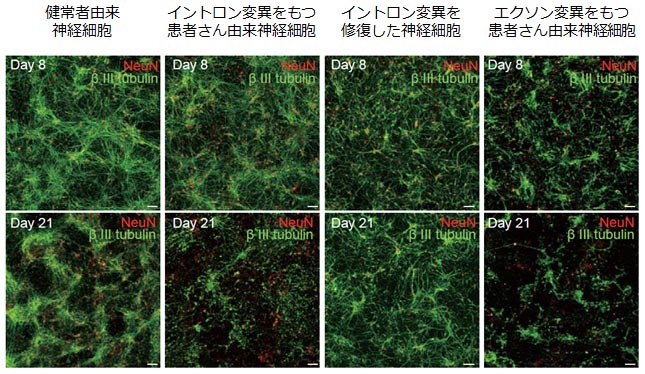 図2. 患者さん由来神経細胞では、細胞が変性しやすい
図2. 患者さん由来神経細胞では、細胞が変性しやすい
3)神経細胞内へのカルシウムイオンの流入が、FTLD-Tauの病態に関与する
最後に、神経細胞の興奮性と異常に折りたたまれたタウタンパク質の間に関連があるかを調べるため、特定の細胞に人工的な受容体を発現させることで、その受容体に結合する薬を投与すると、その細胞のみを活性化させることができるDREADDを用いて、デザイナーiPS細胞を作製し、神経細胞の活動性をコントロールできるシステムを構築しました。このシステムにより、神経細胞内へのカルシウムイオンの流入を阻害したところ、神経細胞内外で異常に折りたたまれたタウタンパク質が減少することが分かりました。この結果から、神経活動に伴い細胞内へ流入したカルシウムイオンがFTLD-Tauの病態に関与することが示唆されました。また、カルシウムイオンの細胞内への流入を阻害すると、FTLD-Tau神経細胞の生存率が上昇することも実験により明らかになりました。
4.まとめ
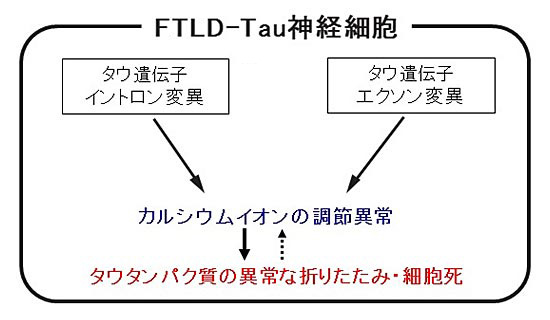 図3. 本研究成果のまとめ
図3. 本研究成果のまとめ
本研究の手法は他の神経変性疾患の研究へも応用が可能と考えられ、今後の研究の進展に貢献するものと期待されます。
5.論文名と著者
- 論文名
- “Calcium dysregulation contributes to neurodegeneration in FTLD patient iPSC-derived neurons”
- ジャーナル名
- Scientific Reports
- 著者
- Keiko Imamura1, Naruhiko Sahara2, Nicholas M. Kanaan3, Kayoko Tsukita1, Takayuki Kondo1, Yumiko Kutoku4, Yutaka Ohsawa4, Yoshihide Sunada4, Koichi Kawakami5,6, Akitsu Hotta1, Satoshi Yawata7, Dai Watanabe7, Masato Hasegawa8, John Q. Trojanowski9, Virginia M. Y. Lee9, Tetsuya Suhara2, Makoto Higuchi2, Haruhisa Inoue1
- 著者の所属機関
-
- 京都大学iPS細胞研究所(CiRA)
- 国立研究開発法人量子科学技術研究開発機構放射線医学総合研究所
- ミシガン州立大学医学部
- 川崎医科大学
- 国立遺伝学研究所
- 総合研究大学院大学
- 京都大学医学研究科
- 東京都医学総合研究所
- ペンシルベニア大学医学大学院
6.本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
- AMED 再生医療実現拠点ネットワークプログラム(疾患特異的iPS細胞を活用した難病研究)
- AMED 再生医療実現化研究事業
- AMED 再生医療実現拠点ネットワークプログラム(iPS細胞研究中核拠点)
- 公益財団法人 持田記念医学薬学振興財団
- 公益財団法人 第一三共生命科学研究振興財団
- JST CREST
- 文部科学省 科学研究費(新学術領域研究 22110007)
- アメリカ国立衛生研究所
7.用語説明
- (注1)前頭側頭葉変性タウオパチー
- タウタンパク質を発現するタウ遺伝子(MAPT遺伝子)の変異により起こる、家族性神経変性疾患の一種。脳の前頭葉と側頭葉に萎縮が見られ、認知症やパーキンソニズムを呈する。タウオパチーは、タウタンパク質が異常蓄積することより起きる神経変性疾患の総称。
- (注2)神経変性疾患
- 脳や脊髄といった中枢神経にある特定の神経細胞が徐々に障害を受けて死んでしまう疾患。代表的なものに、筋萎縮性側索硬化症(ALS)やパーキンソン病などがある。
- (注3)タウタンパク質
- 神経軸索内にある、微小管結合タンパク。微小管は細胞骨格を形成し、細胞内のタンパク質や細胞内小器官の輸送に関わる。タウタンパク質は、微小管の安定性に寄与し、タウタンパク質のうち、微小管結合領域を3つ有するものを3リピートタウ、4つ有するものを4リピートタウと呼ぶ。タウタンパク質の異常蓄積が、アルツハイマー病などの神経変性疾患に関与すると考えられている。
- (注4)DREADD (Designer Receptors Exclusively Activated by Designer Drug)
- 特定の薬(デザイナー薬剤)に選択的に応答する人工的なデザイナー受容体。デザイナー受容体を特定の細胞にのみ発現させ、デザイナー細胞を作製する。デザイナー薬剤を投与すると、目的とする細胞の活動性を制御することができる。ここでは、デザイナー受容体をiPS細胞にのみ発現させ、デザイナーiPS細胞を作製した。デザイナーiPS細胞を目的の細胞である神経細胞に分化させて、デザイナー薬剤を投与することで、神経細胞の活動性を制御した。
- (注5)転写因子
- タンパク質合成は、DNA上の遺伝子を鋳型としてメッセンジャーRNA(mRNA)が転写され、このmRNAが核外のリボソーム上で翻訳される過程で成り立っている。転写因子は、転写開始に関わるタンパク質因子で、DNAに結合して働くものや因子間の相互作用によって機能するものがある。
- (注6)パーキンソニズム
- 手足の振るえ、筋肉のこわばり、動作緩慢、歩行障害などの症状。
- (注7)イントロン
- DNAから転写されたmRNA前駆体にあり、直接タンパク質のアミノ酸配列に関わらない領域。イントロンはmRNAへの転写過程で除かれる。
- (注8)エクソン
- 遺伝子の中で最終的なmRNAになる際に、残っている部分。タンパク質はエクソン部分のみから形成される。
お問い合わせ先
京都大学iPS細胞研究所(CiRA)
研究支援部門 国際広報室
中内
TEL:075-366-7005 FAX:075-366-7185
Email:media“AT”cira.kyoto-u.ac.jp
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 再生医療研究課
〒100-0004 東京都千代田区大手町一丁目7番1号
TEL:03-6870-2220 FAX:03-6870-2242
E-mail:saisei“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
最終更新日 平成28年10月10日


