プレスリリース 「細胞間コミュニケーションを制御する新しい分子メカニズムを解明」―細胞表面タンパク質の切り出し放出を規定する新たな仕組み―
プレスリリース
国立大学法人東京医科歯科大学
国立大学法人九州大学
国立研究開発法人日本医療研究開発機構
ポイント
- 細胞表面のタンパク質を切断して放出させる「シェディング」は、放出されたタンパク質が離れた細胞に作用できるようにすることで、細胞間コミュニケーションを制御する重要な分子機構です。
- 本研究では、ゲノムDNAからタンパク質が作り出される過程で起こる「選択的スプライシング」と「糖鎖修飾」という2つの修飾機構が、作られたタンパク質がシェディングされるかどうかを厳密に決めていることを明らかにしました。
- シェディングは炎症性疾患や細胞の癌化に深く関わるため、本研究成果は、選択的スプライシングや糖鎖修飾をターゲットにしたこれらの疾患の新しい治療方法の開発につながる可能性があります。
東京医科歯科大学医歯学総合研究科臓器代謝ネットワーク講座の白壁恭子ジョイントリサーチ講座准教授の研究グループは、分子内分泌代謝学分野の小川佳宏教授(兼 九州大学大学院 教授)らとの共同研究で、選択的スプライシングと糖鎖修飾という2つの修飾機構が、免疫細胞マクロファージの表面に存在するタンパク質がシェディングされて放出されるかどうかを厳密に決めていることを明らかにしました。本研究は、国立研究開発法人日本医療研究開発機構 革新的先端研究開発支援事業(AMED-CREST)の研究開発領域「生体恒常性維持・変容・破綻機構のネットワーク的理解に基づく最適医療実現のための技術創出」(研究開発総括:永井 良三)※における研究開発課題「細胞間相互作用と臓器代謝ネットワークの破綻による組織線維化の制御機構の解明と医学応用」(研究開発代表者:小川 佳宏)の一環で行われ、その研究成果は、国際科学誌Scientific Reports(サイエンティフィック リポーツ)に、2017年4月10日午前10時(英国時間)にオンライン版で発表されます。※本研究開発領域は、平成27年4月の日本医療研究開発機構の発足に伴い、国立研究開発法人科学技術振興機構(JST)より移管されています。
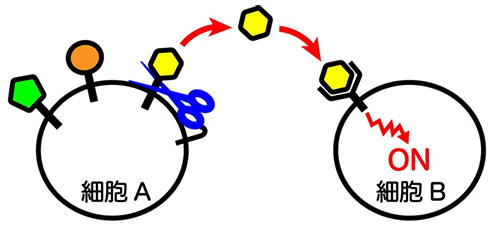 図1.シェディングを介した細胞間コミュニケーション
図1.シェディングを介した細胞間コミュニケーション限られたタンパク質だけが切断・放出され信号を伝える
研究の背景
研究成果の概要
次にCADM1のアミノ酸配列がどのようにしてシェディングされるかどうかを決めているのか調べたところ、CADM1タンパク質には切断を邪魔する糖鎖(図2、水色)が多数付いていること、このアミノ酸配列は糖鎖が付加する部位と細胞膜表面との間に存在し、切断のハサミとなるシェディング酵素が接近するスペースを生み出していること、がわかりました。これらの結果は、ゲノムDNAから細胞表面のタンパク質が作り出される複数のステップのうち、RNAのレベルで起こる「選択的スプライシング」とタンパク質のレベルで起こる「糖鎖修飾」という異なる2つの修飾機構により、作られたタンパク質がシェディングされるかどうかが厳密に決められていることを示しています。
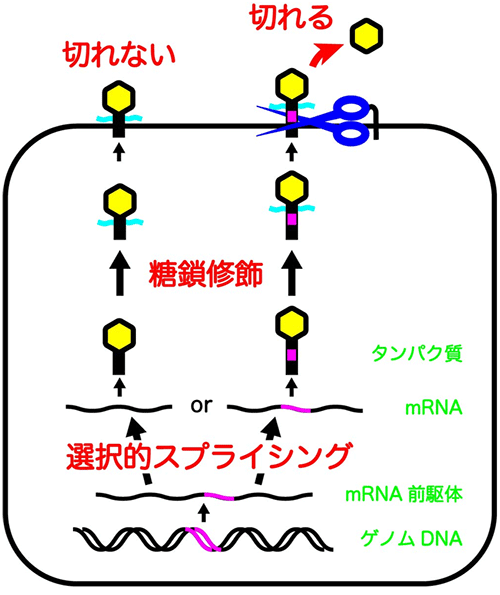 図2.選択的スプライシングと糖鎖修飾によりシェディングされるかどうかが決められる
図2.選択的スプライシングと糖鎖修飾によりシェディングされるかどうかが決められる
研究成果の意義
お問い合わせ先
研究に関すること
臓器代謝ネットワーク講座 白壁恭子(シラカベキョウコ)
TEL:03-5803-5216 FAX:03-5803-0172
E-mail:shirakabe.mem“AT”tmd.ac.jp
東京医科歯科大学大学院医歯学総合研究科 分子内分泌代謝学分野
九州大学大学院医学研究院 病態制御内科学分野
小川佳宏(オガワヨシヒロ)
TEL:03-5803-5966 FAX:03-5803-0261
E-mail:ogawa.mem“AT”tmd.ac.jp
報道に関すること
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5833 FAX:03-5803-0272
E-mail:kouhou.adm“AT”tmd.ac.jp
九州大学 広報室
〒819-0395 福岡市西区元岡744
TEL:092-802-2130 FAX:092-802-2139
E-mail:koho“AT”jimu.kyushu-u.ac.jp
AMEDに関すること
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課
TEL:03-6870-2224 FAX:03-6870-2243
E-mail:kenkyuk-ask“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成29年4月10日
最終更新日 平成29年4月10日


