プレスリリース 組織透明化による全身全細胞解析基盤の構築―がん転移を1細胞ごとに見ることが可能に―
プレスリリース
国立研究開発法人理化学研究所
国立研究開発法人日本医療研究開発機構
発表者
宮園 浩平(東京大学大学院医学系研究科 病因・病理学専攻 分子病理学分野 教授)
田井中 一貴(研究当時:東京大学大学院医学系研究科 機能生物学専攻 システムズ薬理学分野 講師/現所属:新潟大学 脳研究所 特任教授、理化学研究所生命システム研究センター 合成生物学グループ 客員研究員)
江幡 正悟(東京大学大学院医学系科 ライフイノベーションを先導するリーダー養成プログラム 特任准教授)
久保田 晋平(日本学術振興会 特別研究員)
高橋 恵生(東京大学大学院医学系研究科 病因・病理学専攻 分子病理学分野 特任研究員)
西田 純(日本学術振興会 特別研究員)
森下 保幸(東京大学大学院医学系研究科 病因・病理学専攻 人体病理学・病理診断学分野 技術職員)
発表のポイント
- 透明化試薬の屈折率を臓器に最適化することにより組織の透明化技術を向上し、病理学的な全身観察法の確立に成功した。
- 1細胞レベルでの高い解像度のイメージングにより、がんの微小転移の全身・全臓器での解析を可能にした。
- 全身病態の可視化技術の開発により、がんのみならず自己免疫疾患など様々な病気の病態解明や治療法開発が期待される。
発表概要
がんは局所に生じた後に全身に転移する全身性疾患です。がんはそれを取り巻く微小環境と互いに作用し合いながら転移していくことが古くから知られていました。しかし、これまで、がん細胞やがんの微小環境を1個の細胞ごとに高い解像度で、かつ全身・全臓器で包括的に観察することは極めて困難でした。
このたび、東京大学大学院医学系研究科機能生物学専攻システムズ薬理学分野の上田泰己教授(理化学研究所生命システム研究センター 合成生物学グループ グループディレクター 兼任)、久保田晋平日本学術振興会特別研究員と病因・病理学専攻分子病理学分野の宮園浩平教授、高橋恵生特任研究員らの共同研究グループは、すでに開発していた全身・全脳イメージングと解析技術「CUBIC」(注1)の透明化試薬を、屈折率の観点からさらに発展させることにより、マウス個体の全身・全臓器に存在するがん微小転移を1細胞レベルの解像度で解析することを可能にする技術を開発しました。この技術を応用してがん転移の時空間的解析を行うことで、がん細胞による初期の転移巣の形成機構を解明したり、抗がん剤の治療効果を臓器や個体レベルで検証したりすることが可能となりました。
本研究成果は「Cell Reports」オンライン版に掲載されます。
発表内容
研究の背景
がんは日本人の死因の第1位であり、2人に1人の日本人が生涯のうちに一度はがんに罹患すると言われています。がん患者の死因の最も重要なもののひとつはがんの「転移」であり、がん転移のメカニズムを解明することはがんの根治を目指す上で必要不可欠な課題となっています。しかしながら、がん転移のメカニズムの解明には、長年多くの研究がなされているにもかかわらず、未だ明らかになっていない部分が多く、十分な治療法が開発されていないのが現状です。
がん転移の研究には、がん細胞をマウスへ移植し、がん転移が生じる過程を観察するマウスがん転移モデルが広く使用されています。これらマウスがん転移モデルの解析には、従来から使用されている病理組織の解析や抗体を用いた免疫組織化学染色法に加え、近年急速に普及した生物発光イメージング法(注2)などのイメージング技術が活用されており、近年は臓器の深部でのがん細胞の増殖を、時間を追って観察することが可能となってきています。しかしながら、がんは1個の細胞からでも時間を経て大きな転移巣を作ることができると考えられているにもかかわらず、1個もしくは少数のがん細胞からなるがん微小転移を動物実験で検出し、定量化する方法は確立されておらず、がん転移の研究において長年の大きな課題でした。
本研究グループは、がんの病態を分子のレベルから個体のレベルまで統合的に理解するためには、個体・臓器を1細胞レベルの解像度で観察する技術の開発が必要であると考え研究を進めてきました。2014年に本研究グループは、高速三次元撮影が可能であるライトシート顕微鏡(注3)に着目し、この手法を不透明である哺乳類に応用するために組織透明化(注4)という画期的な手法を開発しました。さらに組織透明化を従来の病理組織学的な解析や生物発光イメージング法といった従来の解析手法と組み合わせることによって、個体レベルでの網羅的細胞解析の基盤技術へと発展させました(図1)。
研究手法と成果
マウスがん転移モデルを1細胞レベルの解像度で観察するためにはマウス個体の高度な透明化が必要になります。2014年に本研究グループは血液中の赤色色素「ヘム」に代表される生体色素の脱色に着目することによって、マウスを個体ごと透明化する手法を開発し、幼生マウスの全身イメージングに成功しました。本研究ではさらなる透明化手法の開発を目指し、屈折率の調整の最適化を行いました。その結果、脱脂・脱色試薬 CUBIC-L、屈折率均一化試薬 CUBIC-Rを作製し、成獣マウスの全身イメージングが可能なまでの高度な透明化に成功しました(図2)。
これら高度な個体・臓器の透明化手法により、さまざまな種類のマウスがん転移モデルに透明化手法を応用することが可能となりました(CUBIC-がん解析、CUBIC-Cancer analysis)(注5)。その結果、肺や肝臓への遠隔転移、腹膜播種が個体レベルで観察可能となり、さらには1細胞レベルでのがん微小転移を高い解像度で定量化することが可能となりました(図3)。これらの結果からCUBIC-がん解析ががん転移のメカニズムの解析に極めて有用で、これまで見えなかった1細胞レベルでのがん転移を全個体・全臓器で包括的に見ることが可能であると示唆されました。
そこで、本研究グループはCUBIC-がん解析を応用して、肺がん細胞の上皮間葉移行(epithelial-mesenchymal transition:EMT)(注6)のがん転移への寄与に関する研究を行いました。EMTは原発腫瘍から血管内へと侵入する過程(血管内侵入)に寄与していることが報告されています。一方で、がん細胞が血行性に遠隔臓器へ到達し、血管外へ脱出する過程(血管外脱出)におけるEMTの役割は未だ不明な点が多く残っています。肺がん細胞をマウスの尾静脈から注射すると、ほとんどのがん細胞は肺で転移巣を形成することなく細胞死を起こします。多くのがん細胞は遠隔臓器に到達してもほとんどが死んでしまい、転移巣を作ることは稀であるという、従来の考え方に合致する結果です。一方で、EMTを起こした肺がん細胞を尾静脈から注射すると、多くのがん細胞が細胞死を免れ、血管外へと脱出し、転移巣を形成することがわかりました(図4)。これらの結果から、EMTががん細胞の血管外脱出の過程にも深く関与している可能性を示すことができました。
また、乳がん細胞を用いたマウスがん転移モデルで、抗がん剤の治療効果を臓器レベルで、1細胞ごとに評価する系を樹立しました。がん細胞が抗がん剤に耐性となるメカニズムを解明するためには、抗がん剤耐性を獲得したがん細胞の検出が必須であり、従来の方法と比較してより高感度な検出技術が不可欠です。CUBIC-がん解析はそのようなニーズに応え、がん細胞が抗がん剤投与後も残存している様子を1細胞ごとに観察することに成功しました。抗がん剤を投与してがん細胞が消えてしまったように見えても、わずかな数でもがん細胞が残存しているとそこからがんが再発してくる可能性があります。より有効な抗がん剤の開発のためにも、CUBIC-がん解析は有効であると期待されます。
本研究によりがん研究で使用されている生物発光イメージング法や病理組織学的解析などの従来の方法の橋渡しをする新たな基盤技術としてのCUBIC-がん解析の有用性が示されました。また、全身1細胞解析はがんのみならず自己免疫疾患などの全身性疾患の病因解明や治療法の開発に貢献することが期待されます。
本研究は、日本医療研究開発機構 革新的バイオ医薬品創出基盤技術開発事業、日本医療研究開発機構 革新的がん医療実用化研究事業、科学研究費補助金 基盤研究S、日本学術振興会特別研究員奨励費の支援を得て行われました。
発表雑誌
- 雑誌名:
- 「Cell Reports」(2017年7月5日オンライン版(米国東部夏時間))
- 論文タイトル:
- Whole-Body Profiling of Cancer Metastasis with Single-Cell Resolution
- 著者:
- Shimpei I. Kubota*, Kei Takahashi*, Jun Nishida, Yasuyuki Morishita, Shogo Ehata, Kazuki Tainaka, Kohei Miyazono**, and Hiroki R. Ueda**(*共同第一著者、**責任著者)
- DOI番号:
- 10.1016/j.celrep.2017.06.010
- アブストラクトURL:
- http://dx.doi.org/10.1016/j.celrep.2017.06.010
用語解説
- (注1)CUBIC; Clear, Unobstructed Brain/Body Imaging Cocktails and Computational analysis
- 全身・全脳イメージングと解析プラットフォーム。2014年4月に理研の上田泰己 グループディレクター、洲崎悦生 元基礎科学特別研究員、田井中一貴 客員研究員、Dimitri Perrin(ペリン ディミトリ ジェラード)元国際特別研究員らは脳透明化試薬と全脳イメージングおよび解析手法 Clear, Unobstructed Brain Imaging Cocktails and Computational analysis(CUBIC)を発表した。この脳透明化試薬が持つ血液脱色作用に着目して、東京大学の田井中一貴 元講師、日本学術振興会 特別研究員の久保田晋平らがマウス全身透明化及び幼生マウス全身イメージングを達成した。
- (注2)生物発光イメージング法
- ホタル由来のルシフェラーゼ遺伝子を発現させたがん細胞を移植されたマウスは、がん細胞からのルシフェラーゼによる発光を観察することで、経時的にがん細胞の増殖を観察することが可能となる。
- (注3)ライトシート顕微鏡(light sheet fluorescence microscopy:LSFM)
- シート状のレーザーを左右から照射し、サンプル内の蛍光シグナルを上部に設置されているレンズで検出する顕微鏡である。シート状レーザーの最薄部は10 mmに設置されており、光学セクショニングを行うことで透明なサンプルの高速三次元撮影が可能となる。
- (注4) 組織透明化
- 生体組織には屈折率が異なる様々な物質が存在しているが、その中でも高屈折率を示す脂質を除去することで、光の散乱を抑えることが可能となる。また、生体組織に存在する光を吸収する色素を除去することで光の吸収を抑えることができる。これら光の散乱と吸収をコントロールすることで組織を透明化することが可能となる。
- (注5)CUBIC-がん解析(CUBIC-Cancer analysis)
- CUBIC-based cancer analysisの略。CUBICを組織屈折率の観点から発展させることによって、成獣マウスの全身イメージング、担がんモデルマウスの全身に局在するがん微小転移を一細胞解像度で観察できる。観察したイメージ像を用いた時空間的な解析を行うことによって、臓器レベルでの抗がん剤の治療効果検証などが可能となる。
- (注6)上皮間葉移行(epithelial-mesenchymal transition:EMT)
- お互いに接着し安定している上皮細胞が、細胞間の接着が消失し運動能・浸潤能を有する間葉細胞の性質を示すようになることがある。このような変化は上皮間葉移行 (EMT)と呼ばれる現象であり、がん細胞の浸潤に加え、発生の過程での胚形成や、創傷治癒に関与していると考えられている。EMTを誘導する代表的なサイトカインとしてTGF-βが知られている。
添付資料
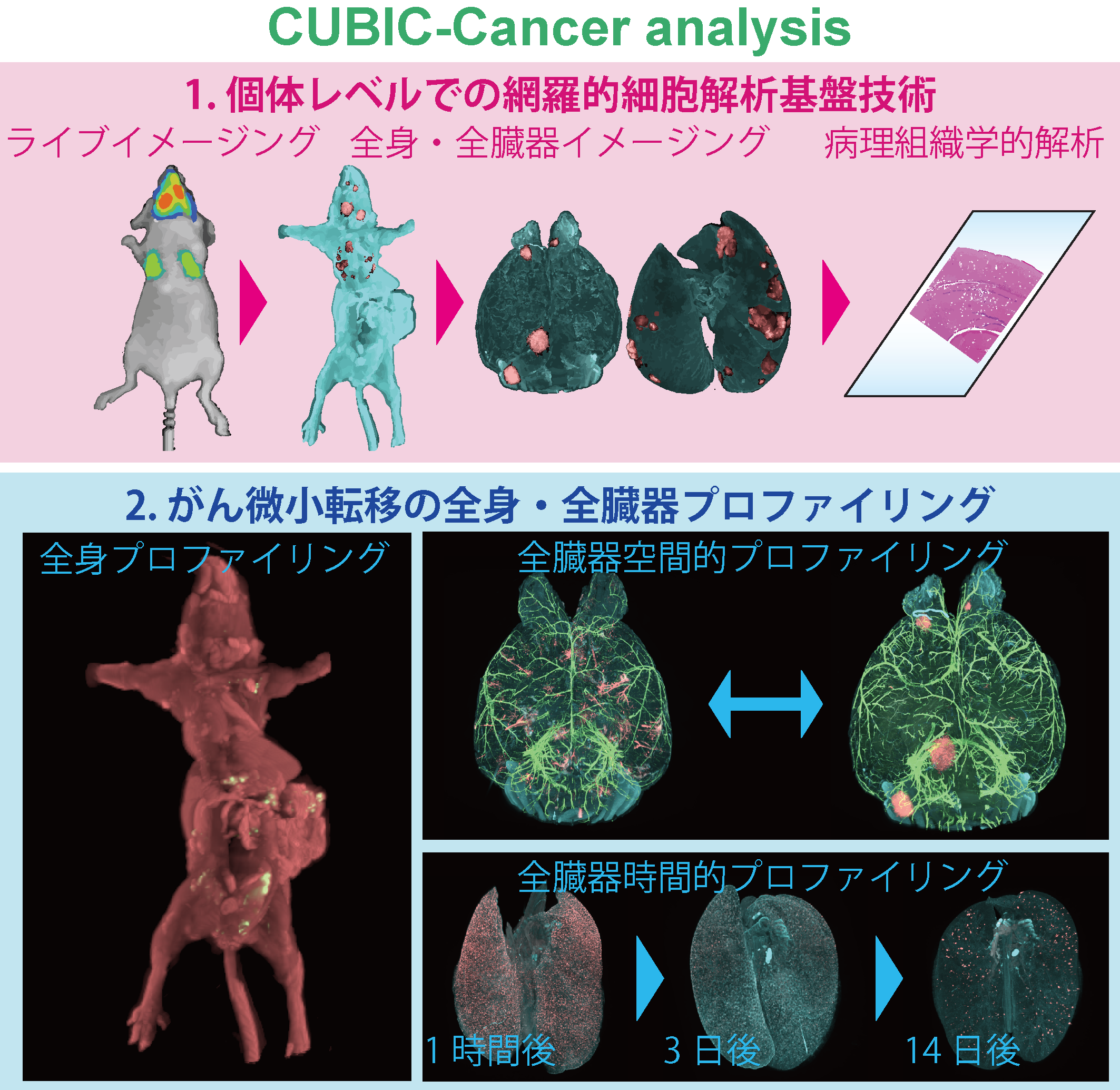
図1.個体レベルでの網羅的細胞解析基盤技術
従来の病理組織学的解析や生物発光イメージング法との間にあった溝を、1細胞解像度の全身・全臓器イメージングは埋めることが可能である。全身イメージングによって全身に存在するがん微小転移のプロファイリングが、また全臓器イメージングによって時空間的なプロファイリングが可能となった。
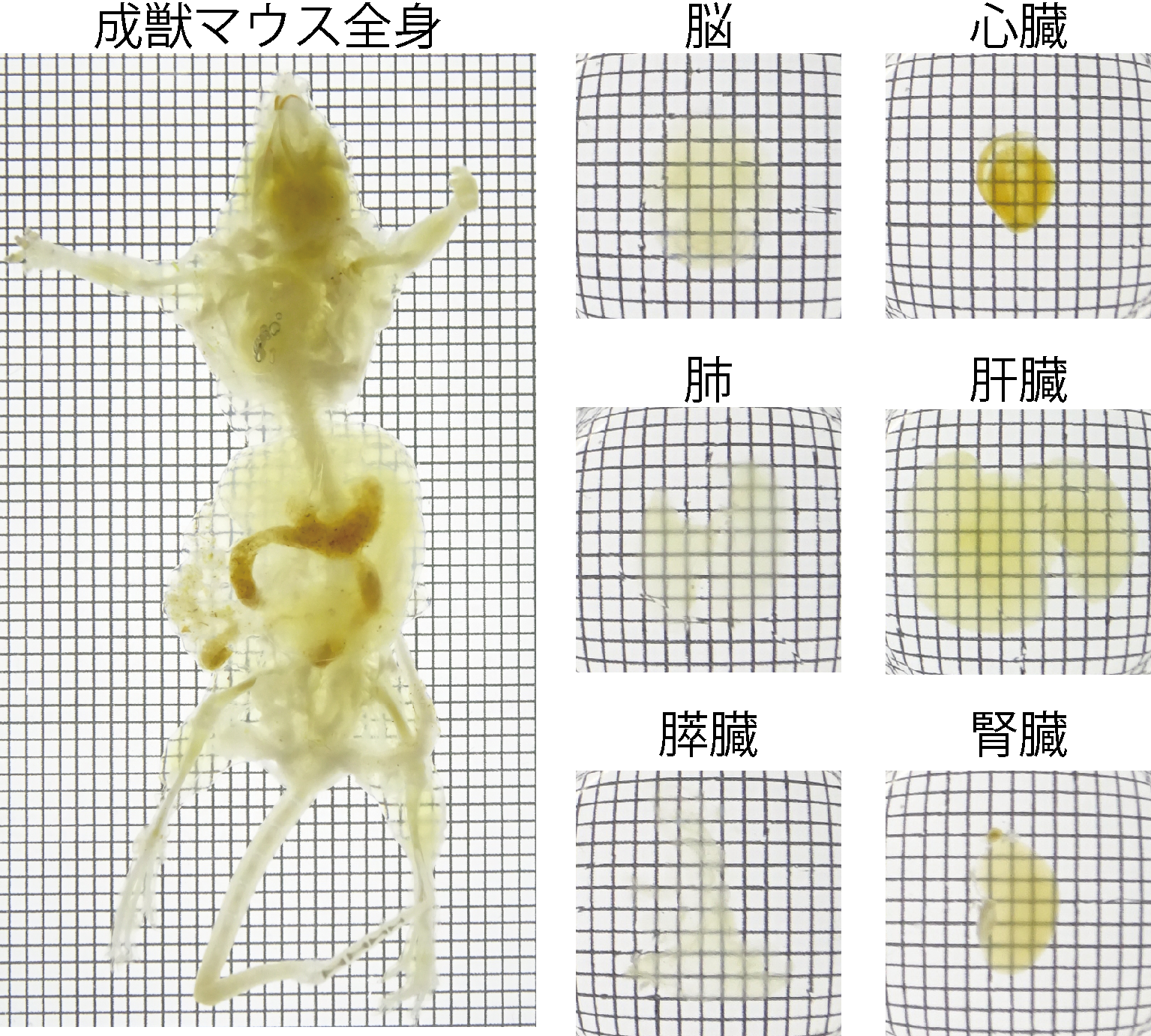
図2.成獣マウスの全身・全臓器の高度な透明化
透明化試薬の屈折率を臓器毎に最適化することによって、マウスの全身・全臓器の高度な透明化が達成された。
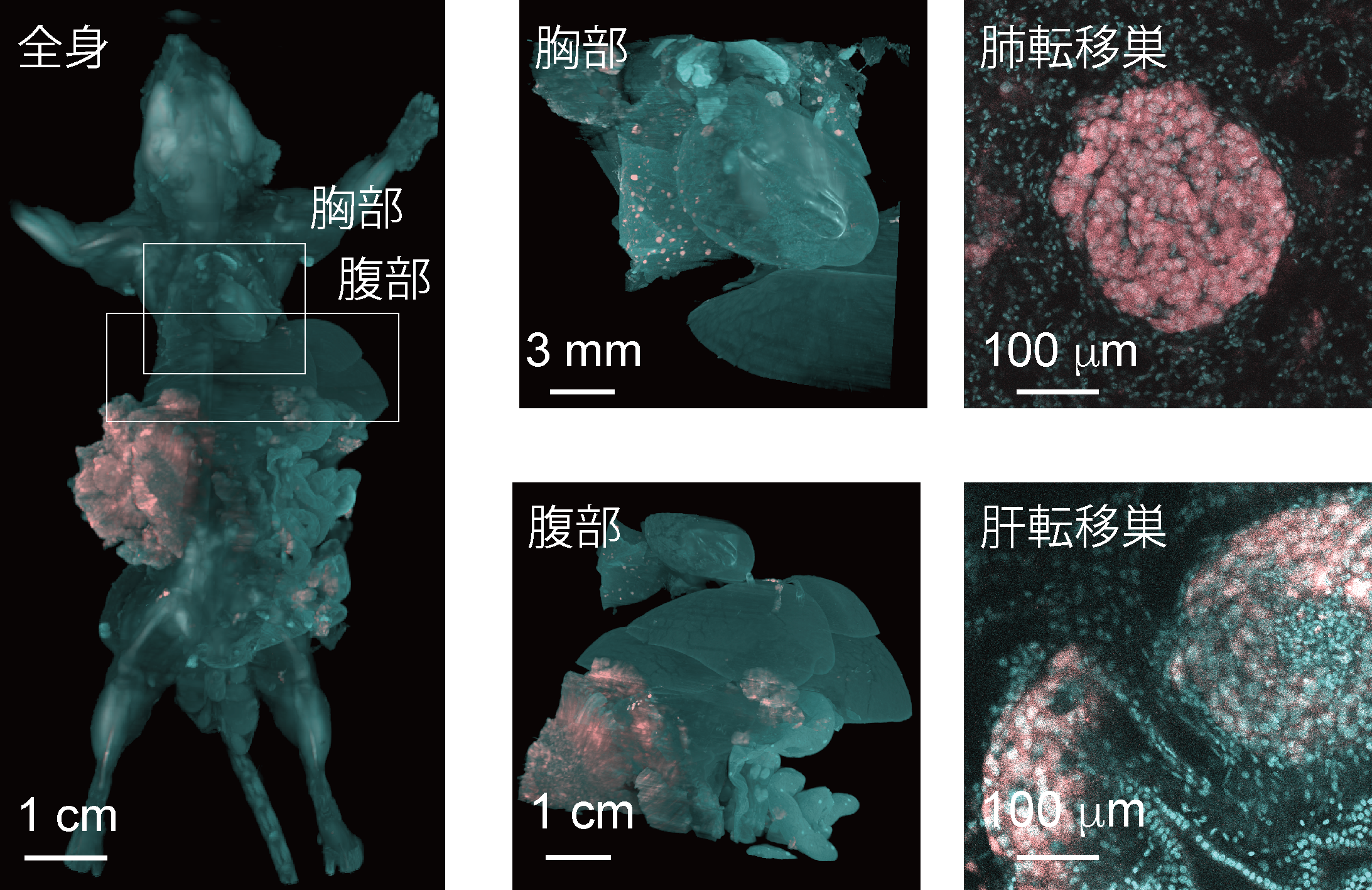
図3.1細胞解像度での担がんモデルマウスイメージング-腎臓がんの例
蛍光タンパク質(赤色: mCherry)を発現している腎がん細胞を腎臓に移植することによって全身のがん転移を誘導した。成獣マウスは細胞核が染まる蛍光色素(青色: RedDot2)で染色されている。原発巣である腎臓から胸部・腹部へと遠隔転移していることが観察でき、また全身に点在する一つ一つの転移巣をプロファイリングすることも可能である。
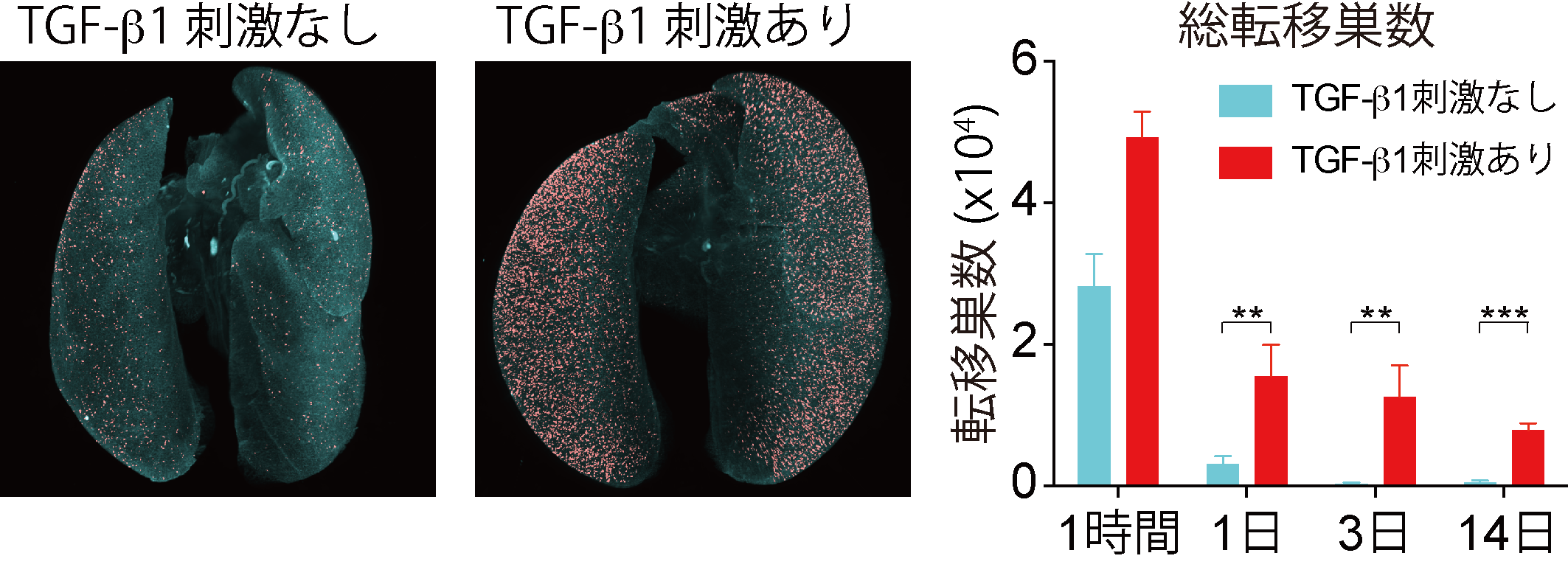
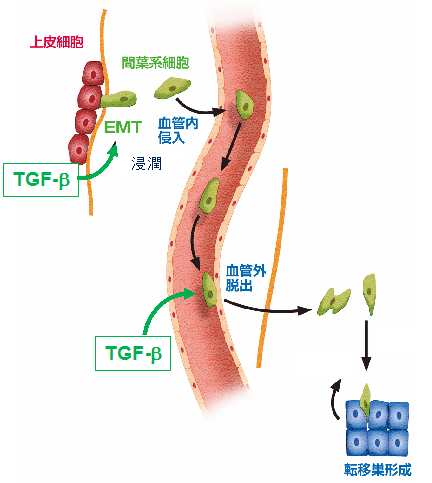
図4.1細胞解像度での担がんモデルマウスイメージング-肺がんの例
(上図)蛍光タンパク質(赤色: mCherry)を発現している肺がん細胞を尾静脈投与することによって肺に転移を誘導した。TGF-bというタンパク質で刺激を行なった肺がん細胞は、移植1日後の時点で細胞死を起こさず、血管外へ脱出し、転移巣形成することを明らかにした。
(下図)がんが転移する際にはがん細胞は血管内へ侵入し、遠隔の臓器に到達し、そこで血管外へ脱出して転移巣を形成する。本研究でTGF-bというタンパク質で上皮間葉移行(EMT)を起こした細胞は血管内へ侵入しやすいだけでなく、血管外へ脱出しやすい傾向を持つことが明らかとなった。
問い合わせ先
研究に関するお問い合わせ
東京大学大学院医学系研究科 機能生物学専攻 システムズ薬理学分野
教授 上田 泰己(うえだ ひろき)
〒113-0033 東京都文京区本郷7-3-1
TEL:03-5841-3415
E-mail:uedah-tky“AT”umin.ac.jp
東京大学大学院医学系研究科 病因・病理学専攻 分子病理学分野
教授 宮園 浩平(みやぞの こうへい)
〒113-0033 東京都文京区本郷7-3-1
TEL:03-5841-3356
E-mail:miyazono“AT”m.u-tokyo.ac.jp
事業に関するお問い合わせ
国立研究開発法人 日本医療研究開発機構(AMED)
創薬戦略部 医薬品研究課
〒100-0004 東京都千代田区大手町1-7-1読売新聞ビル
TEL:03-6870-2219、FAX:03-6870-2244
E-mail:kaku-bio27“AT”amed.go.jp
国立研究開発法人 日本医療研究開発機構(AMED)
戦略推進部 がん研究課
〒100-0004 東京都千代田区大手町1-7-1読売新聞ビル
TEL:03-6870-2221
報道に関するお問い合わせ
東京大学大学院医学系研究科 総務係
〒113-0033 東京都文京区本郷7-3-1
TEL:03-5841-3304、FAX:03-5841-8585
E-mail:ishomu“AT”m.u-tokyo.ac.jp
国立研究開発法人理化学研究所
広報室 報道担当
〒351-0198 埼玉県和光市広沢2-1
TEL:048-467-9272、FAX:048-462-4715
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成29年7月6日
最終更新日 平成29年7月6日


