脊髄小脳変性症36型の病態を細胞レベルで改善する アンチセンスオリゴヌクレオチドの同定
プレスリリース
国立研究開発法人日本医療研究開発機構
ポイント
- 脊髄小脳変性症36型(SCA36)注1は、脊髄小脳変性症をきたす神経難病で、日本で発見された。筋萎縮性側索硬化症(ALS)注2に似た症状が合併する。現在のところ十分な治療法がない。
- SCA36患者さん由来のiPS細胞から神経細胞を作製し、疾患病態を再現した。
- アンチセンスオリゴヌクレオチド(ASO)注3を用いてSCA36の病態の一部を細胞レベルで改善させた。
要旨
松薗構佑医師(当時岡山大学大学院医歯薬学総合研究科 脳神経内科学[阿部康二教授]大学院生、当時CiRA特別研究学生)および井上治久教授(京都大学CiRA増殖分化機構研究部門)らの研究グループは、脊髄小脳変性症36型(SCA36)患者さん由来のiPS細胞から神経細胞を作製してSCA36の病態の一部を再現し、その病態を改善するアンチセンスオリゴヌクレオチド(ASO)を見つけました。
SCA36は遅発性で緩徐進行性の運動神経細胞の障害を伴った脊髄小脳変性症です。NOP56という遺伝子内に存在する6塩基の繰り返し配列(GGCCTG)が異常に増えることが、本疾患の原因であることが分かっています。また、近年、異常な繰り返し配列がRNA凝集体を形成し、神経の病気に関連することが知られています。本研究では、SCA36患者さんからiPS細胞を作製し、更に神経細胞へと分化させました。すると、患者さん由来のiPS細胞およびそのiPS細胞から分化させた神経細胞では、RNA凝集体が増えていることが分かりました。そこで、繰り返し配列(GGCCTG)を標的としたアンチセンスオリゴヌクレオチド(ASO)を患者さんの細胞に加えたところ、これらのRNA凝集体を減らしました。
本研究は、SCA36に対するアンチセンスオリゴヌクレオチド(ASO)の効果を評価する上で、iPS細胞を用いた研究が有効な手段であることを示し、今後のSCA36をはじめとする繰り返し配列異常が原因の疾患への治療薬開発研究に貢献するものと期待されます。
この研究成果は2017年7月10日(米国時間)に米国科学誌「Molecular Therapy – Nucleic Acids」でオンライン公開されました。
研究の背景
脊髄小脳変性症36型(SCA36)は、NOP56という遺伝子内に存在する6塩基の繰り返し配列(GGCCTG)が異常に増えることが原因の疾患です。発症年齢の平均は50歳台で、小脳性運動失調や四肢の進行性の運動神経症状を呈する疾患です。
近年、繰り返し配列の異常増加が原因である疾患の治療開発において、アンチセンスオリゴヌクレオチドなどの核酸を用いた「核酸医薬」が期待されています。
研究結果
SCA36患者さん由来のiPS細胞から神経細胞を作製し、病態を再現した。
まず、本研究グループは、健康な方とSCA36患者さんのiPS細胞を作製し、神経細胞に分化させました。すると、SCA36患者さん由来のiPS細胞や神経細胞では、健康な方に比べ、RNA凝集体を持つ細胞の数が増えていることが分かりました(図1)。
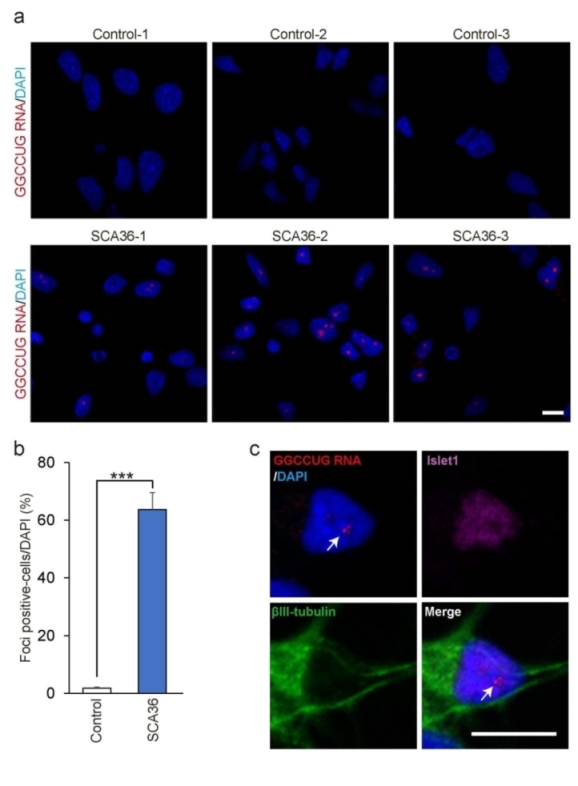 図1.a. 健康な方由来(上段)とSCA36患者さん由来(下段)の神経細胞の様子
図1.a. 健康な方由来(上段)とSCA36患者さん由来(下段)の神経細胞の様子
βⅢ-tubulin; 神経細胞のマーカー)スケールバー;10μm。
アンチセンスオリゴヌクレオチド(ASO)がSCA36のRNA凝集体を減少させた。
次に、塩基配列の違う5種類のアンチセンスオリゴヌクレオチド(ASO) を作り(ASO-A/B/C/D/E、このうちASO-AのみRNA切断を生じないようにデザイン)、SCA36患者さん由来のiPS細胞とそのiPS細胞から分化した神経細胞へ添加しました。すると、患者さん由来のiPS細胞と神経細胞において、約50%のRNA凝集体陽性の細胞数を減らしました。また、ASO-Aは、NOP56のmRNA発現量を変えることなく、RNA凝集体陽性の細胞数を減らしました(図2)。
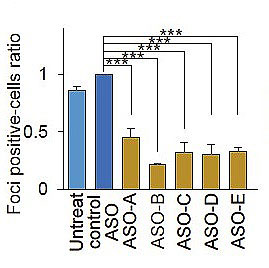 図2.SCA36神経細胞におけるアンチセンスオリゴヌクレオチド(ASO)のRNA凝集体抑制効果
図2.SCA36神経細胞におけるアンチセンスオリゴヌクレオチド(ASO)のRNA凝集体抑制効果
まとめ
SCA36患者さん由来のiPS細胞を用いて、SCA36の病態の一部を再現しました。さらに、SCA36の病態を細胞レベルで改善させるアンチセンスオリゴヌクレオチド(ASO)を同定しました。特に、RNAを分解しない構造のアンチセンスオリゴヌクレオチド(ASO)が、NOP56のmRNA発現量を変えることなく、RNA凝集体を減らすことが分かりました。
本研究は、SCA36におけるアンチセンスオリゴヌクレオチド(ASO)の有効性を評価する上で、iPS細胞を用いた疾患モデルが有効な手段であることを示し、今後のSCA36をはじめとする繰り返し配列異常が原因である疾患の治療薬開発研究に貢献するものと期待されます。
論文名と著者
- 論文名:
- “Antisense oligonucleotides reduce RNA foci in spinocerebellar ataxia 36 patient iPSCs”
- ジャーナル名:
- Molecular Therapy – Nucleic Acids
- 著者:
- Kosuke Matsuzono1,2, Keiko Imamura1, Nagahisa Murakami1,3, Kayoko Tsukita1, Takuya Yamamoto1, Yuishin Izumi3, Ryuji Kaji3, Yasuyuki Ohta2, Toru Yamashita2, Koji Abe2, Haruhisa Inoue1
- 著者の所属機関:
-
- 京都大学iPS細胞研究所(CiRA)
- 岡山大学大学院医歯薬学総合研究科 脳神経内科学
- 徳島大学大学院 医歯薬学研究部 臨床神経科学(神経内科)
本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
- AMED 再生医療実現拠点ネットワークプログラム(疾患特異的iPS細胞を活用した難病研究)
- AMED 再生医療実現拠点ネットワークプログラム(iPS細胞研究中核拠点)
- AMED 再生医療実用化研究事業
- 公益財団法人 第一三共生命科学研究振興財団
用語解説
- 注1)脊髄小脳変性症36型(SCA36)
- 家族性脊髄小脳変性症のひとつ。20番染色体の上にあるNOP56という遺伝子のイントロン1内に存在する6塩基の繰り返し配列(GGCCTG)が異常に増えることが、本疾患の原因になることを2011年に京都大学と岡山大学の研究グループらが明らかにした。
- 注2)筋萎縮性側索硬化症(ALS)
- 運動神経細胞が選択的に変性・消失していく原因不明の疾患。筋萎縮と筋力低下が主な症状で、進行すると上肢の機能障害、歩行障害、嚥下障害、呼吸障害などを生じる。病気を起こすメカニズムは詳しく知られておらず、まだ十分な治療法ない。
- 注3)アンチセンスオリゴヌクレオチド(ASO)
- 標的とする配列に相補的な15~20個程度の塩基からなるDNAやRNAである。相補的な配列に結合して、RNAのスプライシングやタンパク翻訳などを阻止する働きがある。
お問い合わせ先
京都大学iPS細胞研究所(CiRA)
研究支援部門 国際広報室
大内田 美沙紀
TEL: 075-366-7005
E-mail: media“AT”cira.kyoto-u.ac.jp
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 再生医療研究課
TEL:03-6870-2220 FAX:03-6870-2242
E-mail:saisei“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成29年7月10日
最終更新日 平成29年7月10日


