プレスリリース iPS細胞由来神経堤細胞を用いてシャルコー・マリー・トゥース病の病態に関連する分子変化を解明
プレスリリース
京都府立医科大学
国立研究開発法人日本医療研究開発機構
ポイント
シャルコー・マリー・トゥース病(CMT)注1は遺伝子変異により筋萎縮と感覚障害が進行する病気で、病理学的に脱髄型と軸索型に分かれる。根治療法は見つかっていない。
-
脱髄型CMT患者さんのiPS細胞由来神経堤細胞注2を用いて遺伝子発現解析を行ったところ、酸化ストレスに関連するGSTT2注3遺伝子発現が上昇していた。
-
患者さんのiPS細胞由来神経堤細胞では、活性酸素種注4の産生が上昇していた。
1.要旨
森井芙貴子大学院生(京都府立医科大学大学院医学研究科、元・CiRA特別研究学生)、中川正法教授(京都府立医科大学大学院医学研究科)、水野敏樹教授(京都府立医科大学大学院医学研究科)および井上治久教授(CiRA増殖分化機構研究部門)らの研究グループは、シャルコー・マリー・トゥース病(CMT)の患者さんから樹立したiPS細胞を用いて神経堤細胞を作製し、CMTの病態に関連する分子変化の一端を解明することに成功しました。
CMTは世界中でもっとも頻度の高い遺伝性末梢神経障害で、若年期から筋萎縮と感覚障害が進行する病気です。CMTは病理学的に脱髄型CMTと軸索型CMTの二つに分類されます。全体の6割以上を占める脱髄型CMTはシュワン細胞注5の変性によって引き起こされ、これまでに数多くの原因遺伝子が報告されています。
本研究では、脱髄型CMT患者さんからiPS細胞を作製し、健康な方(対照群)と比較することで病態の解析を行いました。はじめに、樹立したiPS細胞から、シュワン細胞を作り出す幹細胞である神経堤細胞へ、分化させました。この神経堤細胞を用いて遺伝子発現解析を行うと、患者さんのiPS細胞由来神経堤細胞ではグルタチオン転移酵素の一種であるGlutathione S-transferase theta2(GSTT2)の遺伝子発現が上昇していました。また、患者さんのiPS細胞由来神経堤細胞では活性酸素種の産生が上昇していました。
これにより、脱髄型CMTに関与する早期の分子変化の一端が明らかになりました。今後研究を進めることで、さらなる病気のメカニズムの解明と、治療法の開発につながることが期待されます。
この研究成果は2017年7月12日(日本時間)に国際科学誌「NeuroReport」で公開されました。
2.研究の背景
CMTは世界で最も患者数の多い遺伝性末梢神経障害ですが、現在までのところ有効な治療法がありません。CMTを引きおこす遺伝子異常としては、最も患者数の多いPMP22重複注6をはじめ、MPZ注7やEGR2注8点変異(塩基配列の1箇所だけが変異している異常)など、これまでに80以上報告されています。CMTは病理学的に脱髄型CMTと軸索型CMTに分けられ、従来の脱髄型CMTの研究はシュワン細胞を用いて行われてきました。
脱髄型CMTの病気のメカニズムについて、詳細は明らかではありません。そこで、本研究グループは、脱髄型CMTの患者さんからiPS細胞を樹立し、シュワン細胞を作り出す幹細胞である神経堤細胞へと分化誘導することで、胎生期から存在しうるCMTの病態に注目して解析しました。
3.研究結果
1.脱髄型CMT患者さん由来iPS細胞から作製した神経堤細胞では、GSTT2遺伝子発現が上昇している
まず、研究グループは、脱髄型CMT患者さん5名(原因遺伝子としてはPMP22重複3名、MPZ点変異1名、EGR2点変異1名)と、健常人3名からiPS細胞を樹立し、神経堤細胞へ分化させました。脱髄型CMT患者と健常人の間では、iPS細胞から神経堤細胞への分化のしやすさに差はありませんでした。一方で、iPS細胞から分化誘導した神経堤細胞の遺伝子発現パターンを比較すると、脱髄型CMT患者の神経堤細胞では細胞の解毒に関わるグルタチオンS転移酵素の一種であるGSTT2の遺伝子発現が上昇していることがわかりました(図1)。
2.脱髄型CMT患者さん由来iPS細胞から作製した神経堤細胞では、活性酸素種の産生が上昇している
活性酸素種は細胞に損傷を与えうる、反応性の高い有害な物質と考えられています。活性酸素種が細胞膜や細胞小器官と反応して過酸化脂質を生成し、この過酸化脂質はDNAやタンパク質の正常な代謝を障害すると考えられ、GSTT2は過酸化脂質を代謝する酵素の一つです。脱髄型CMT患者のiPS細胞から分化誘導した神経堤細胞では、健常人にくらべて、この活性酸素種の産生が上昇していました(図2)。
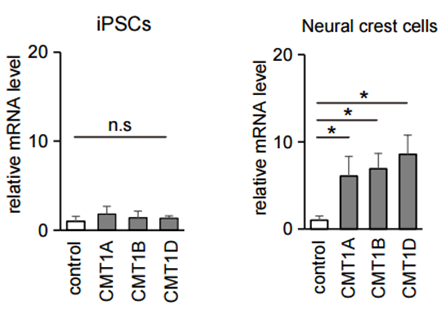 図1.GSTT2遺伝子の発現量比較
図1.GSTT2遺伝子の発現量比較
iPS細胞の状態ではGSTT2の遺伝子発現に、健常人とCMT患者の間で差はない(左側)。
CMT患者さんのiPS細胞から分化誘導した神経堤細胞では、GSTT2遺伝子発現が上昇している(右側)。iPSCs;iPS細胞、Neural crest cells;神経堤細胞、Control;対照群として用いた健常人由来の細胞、CMT1A;PMP22重複、CMT1B;MPZ点変異、CMT1D;EGR2点変異、n.s;有意差なし、*;p<0.05。
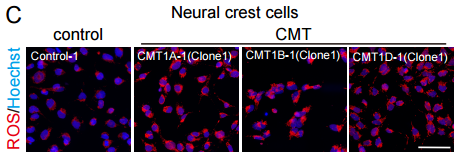
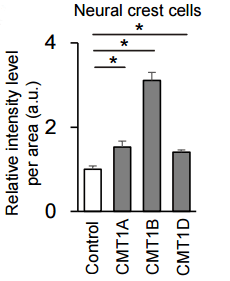 図2.CMT患者の神経堤細胞で活性酸素種が増える
図2.CMT患者の神経堤細胞で活性酸素種が増える
CMT患者さんのiPS細胞から分化誘導した神経堤細胞では、活性酸素種がより多く細胞内に見られる(上)。スケールバーは100 μm。iPS細胞から分化誘導した神経堤細胞における活性酸素種を定量化したグラフ(下)。ROS:活性酸素種、Neural crest cells:神経堤細胞、Control:対照群として用いた健常人由来の細胞、CMT1A:PMP22重複、CMT1B:MPZ点変異、CMT1D:EGR2点変異、*:p<0.05
4.まとめ
本研究では、脱髄型CMT患者さん由来iPS細胞を用いて神経堤細胞を作製し、遺伝子発現解析によってGSTT2の遺伝子発現が上昇していることを示し、また活性酸素種の産生も上がっていることを明らかにしました。複数の遺伝的背景をもつ脱髄型CMTで、シュワン細胞の前駆細胞である神経堤細胞に共通の分子的変化が見られたことは、今後のCMTの病気のメカニズムの研究や治療法の探索に貢献するものと期待されます。
5.論文名と著者
- 論文名:
- “Analysis of neural crest cells from Charcot-Marie-Tooth disease patients demonstrates disease-relevant molecular signature”
- ジャーナル名:
- NeuroReport
- 著者:
- Fukiko Kitani-Morii1,2*, Keiko Imamura1, Takayuki Kondo1, Ryo Ohara2, Takako Enami1, Ran Shibukawa1, Takuya Yamamoto1, Kazuya Sekiguchi1, Junya Toguchida1,3, Toshiki Mizuno2, Masanori Nakagawa4, Haruhisa Inoue1#
- * 筆頭著者
# 責任著者
- 著者の所属機関:
-
- 京都大学iPS細胞研究所
- 京都府立医科大学大学院医学研究科 神経内科学
- 京都大学再生医科学研究所
- 京都府立医科大学大学院医学研究科 医療フロンティア展開学
6.本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
- AMED再生医療実現拠点ネットワークプログラム(疾患特異的iPS細胞を活用した難病研究)
- AMED再生医療実現拠点ネットワークプログラム(iPS細胞研究中核拠点)
- 公益財団法人 第一三共生命科学研究振興財団
- AMED 難治性疾患実用化研究事業
7.用語解説
- 注1)シャルコー・マリー・トゥース病(CMT)
- 末梢神経の障害により、若年期から筋萎縮と感覚障害がゆっくり進行する疾患。約2,500人に1人の患者が存在する。病理学的に、神経細胞の髄鞘が一次的に障害される脱髄型CMTと、神経細胞の軸索が一次的に障害される軸索型CMTに分類される。これまで80を越える原因遺伝子が報告されている。
- 注2)神経堤細胞
- 胚発生の途中で生じる遊走能をもった幹細胞で、筋骨格系細胞やメラニン細胞、末梢神経系細胞やシュワン細胞などへ分化することができる。
- 注3)GSTT2(ASO)
- GSTT2は、Glutathione S-transferase theta 2の略。細胞の解毒に関与するグルタチオン転移酵素のサブファミリーの一つで、フリーラジカルや過酸化物といった活性酸素種から細胞を保護する役割がある。
- 注4)活性酸素種
- 酸素分子がより反応性の高い化合物に変化したものの総称で、免疫細胞が細菌など異物を分解する際に利用されるが、細胞内のDNAやタンパク質を損傷するなど有害な性質も持つ。
- 注5)シュワン細胞
- 末梢神経の軸索を支持する細胞で、髄鞘とよばれる特有の構造物を作って末梢神経の長い軸索に巻きつき、軸索を機械的・栄養的に保護する。脱髄型CMTにおける病態の首座といわれている。
- 注6)PMP22重複
- PMP22は、Peripheral myelin protein 22-kDaの略。PMP22重複はPMP22遺伝子を3コピーもっている状態のことで、脱髄型CMTの中で最も頻度が高い遺伝子異常。
- 注7) MPZ
- MPZは、Myelin protein zeroの略。髄鞘タンパクを作る遺伝子の一つ。
- 注8)EGR2
- EGR2は、Early growth response 2の略。シュワン細胞が髄鞘を作る時に必要な転写因子の一つ。
お問い合わせ先
京都大学iPS細胞研究所(CiRA)
研究支援部門 国際広報室
TEL: 075-366-7005 FAX: 075-366-7185
E-mail: media“AT”cira.kyoto-u.ac.jp
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 再生医療研究課
〒100-0004 東京都千代田区大手町一丁目7番1号
TEL:03-6870-2220 FAX:03-6870-2242
E-mail:saisei“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成29年7月21日
最終更新日 平成29年7月21日


