プレスリリース 「自家滑膜幹細胞の半月板損傷を対象とする医師主導治験」開始のお知らせ―国内で初めての半月板損傷患者を対象とした再生医療等製品の治験開始―
プレスリリース
国立研究開発法人日本医療研究開発機構
ポイント
- 東京医科歯科大学医学部附属病院において、再生医療の医師主導治験を開始します。
- 半月板損傷患者を対象とした幹細胞移植の治験は日本で初めてです。
- 今後、治験の結果を受けて、再生医療等製品としての承認を目指します。
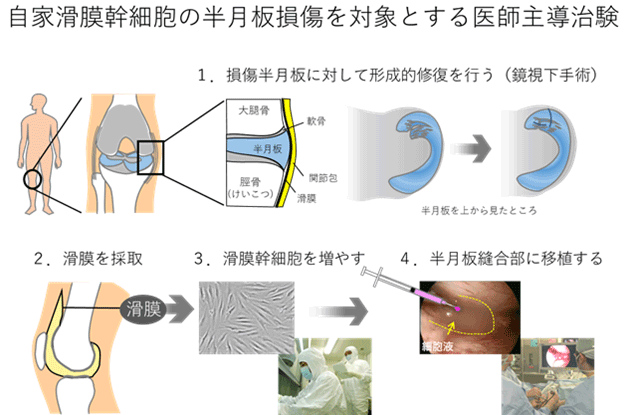
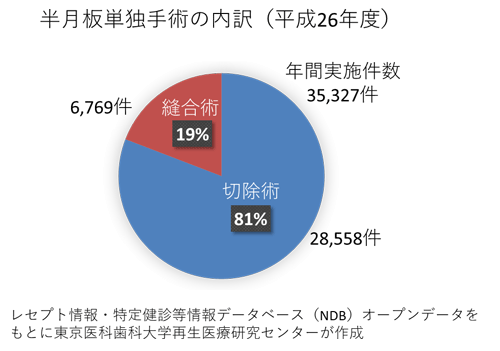
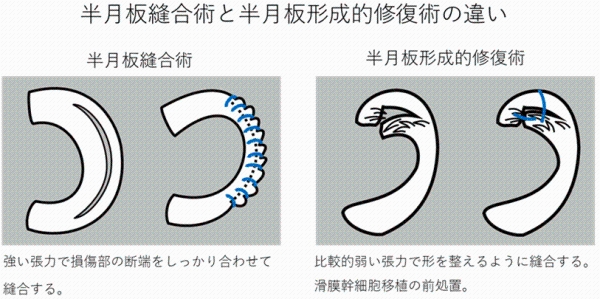
日本では半月板手術の80%が切除術であり、変形性膝関節症の高リスク群となっています。関矢教授らは低侵襲手術と細胞移植を組み合わせた革新的な新規治療法として、一般的には半月板切除術の適応となる半月板損傷に対して縫合術を行い、その際に、採取した膝関節内の滑膜から細胞を分離し、生体外で培養拡大後、再び、半月板に移植する医療技術を開発しました。平成25年12月には、世界で初めてとなる「半月板損傷を対象とした自家培養滑膜幹細胞移植」の臨床研究を開始し、平成27年4月までに5例の臨床研究を実施しました。これら5例の術後2年経過において、重篤な有害事象を認めず、全例において、臨床スコアの改善を認めました。
これらの成果をもとに平成29年3月27日に独立行政法人医薬品医療機器総合機構に治験届「自家滑膜幹細胞の半月板損傷を対象とする医師主導治験」を提出しました。
背景
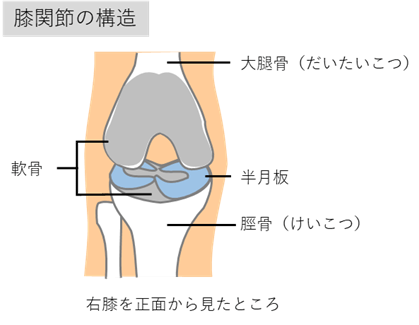
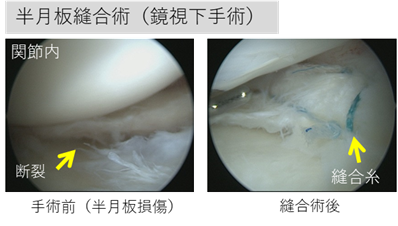
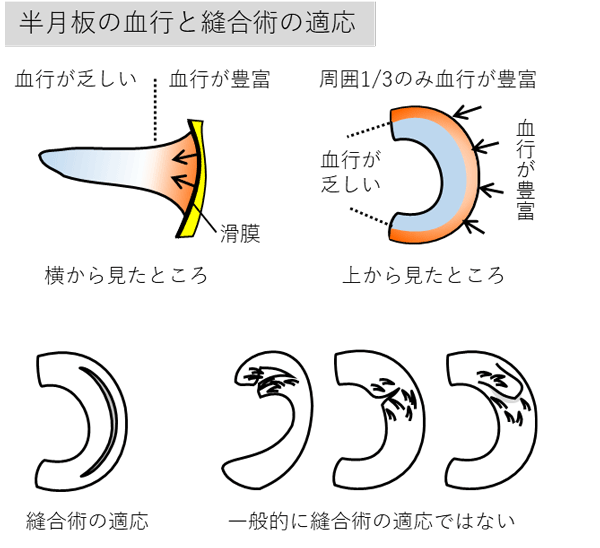
半月板損傷の治療では半月板を温存する手術として損傷した部分を縫い合わせる半月板縫合術が行われていますが、縫合術が可能である半月板断裂の状態が限られていること、再断裂の可能性があることなどの理由から、必ずしも縫合術が積極的に行なわれている状況ではありません。縫合術が不適応でやむなく広範囲に半月板を切除した場合には関節の軟骨がすり減る変形性膝関節症を発症します。さらに、部分切除でも膝機能に及ぼす影響は少なくないことが報告されており、できるだけ半月板を温存する半月板縫合術が推奨されています。
治験の概要
治験の意義
対象患者とスケジュール
対象は、半月板切除術の適応となる半月板損傷を有する患者で、下記1~5のすべての基準を満たし、17項目の除外基準のいずれにも抵触しない患者です。
- 同意取得時の年齢が満20歳以上の本人から文書同意の取得が可能な患者。
- 半月板の血行の有無を問わず、放射状断裂、垂直フラップ断裂、水平フラップ断裂、水平断裂、複合断裂を有する患者。半月板の血行の存在しない内縁部から中央部の断裂を有する患者。半月板変性断裂を有する患者。
- 半月板損傷の臨床症状で疼痛を有する患者。
- 下記のいずれかの症状をひとつ以上呈している患者。
・不安定感(日常生活や運動の際に膝の安定感を欠く症状)
・可動域障害
・関節水腫
5.上記2~4のため、100mm2以上の半月板切除術の適応となる患者。
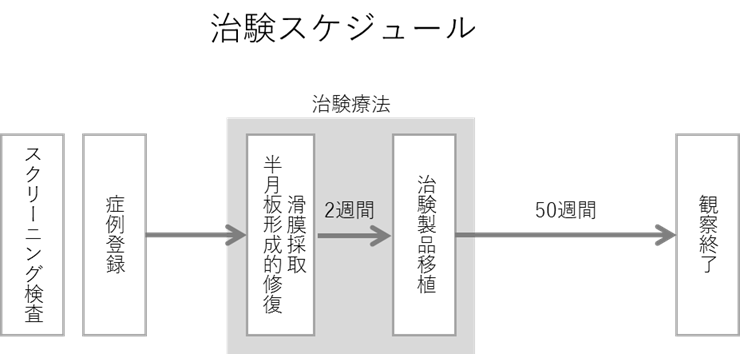
本治験は、非盲検単群試験であるため、すべての研究参加者に同一の治験療法を行います。はじめに、患者さんがこの臨床試験に参加することが適切かどうかを判断するための検査(スクリーニング検査)を行います。 参加できると判断した場合には、この臨床試験に症例登録します。治験療法では、あらかじめ、培養液添加用の血清を得るために、約300gの血液を採取した後に半月板形成的修復術を行い、その約2週間後に自家滑膜幹細胞(治験製品)を移植します。半月板形成的修復術後52週間の経過観察、および、MRI検査、関節鏡検査を含む検査により、有効性と安全性を探索的に確認します。
治験参加の方法
募集内容は7月末に大学のホームページに掲載する予定です。本治験での目標症例数は10例で、既に本学医学部附属病院整形外科に通院中の方、他医療機関からの紹介などにより本院を受診した方、今後、本院を受診する予定の一般の方が対象です。募集期間は2018年1月まで、または症例数が目標の10名に達するまでです。参加期間は、治験への参加に最初に同意してから約1年3か月を予定しています。
本治験では、半月板形成的修復術と治験製品移植は、入院を伴う手術となります。治験製品移植に関する入院費用・手術費用は研究費から支払われますが、半月板修復術に関する入院費・手術費用は患者さん本人の負担となります。その他にもMRI検査など患者さん本人の負担となる費用があり、取り決めが行われています。実際の患者さん本人の病院への支払額は患者さんの加入する保険の種類によって異なります。
本治験への参加をご希望の一般の方は、末尾の【問い合わせ先】からお問い合わせください。
特記事項
支援を受けた公的研究費は次のとおりです。
- 日本医療研究開発機構 再生医療実用化研究事業
(再生医療等製品の薬事承認申請を目指した医師主導治験の推進に対する支援)
- 日本医療研究開発機構 再生医療の産業化に向けた評価基盤技術開発事業(再生医療等の産業化に向けた評価手法等の開発)
(軟骨・半月板を対象とした再生医療等製品に対するMRI三次元画像を用いた合理的な評価手法の開発に対する支援)
用語解説
- 1)再生医療等製品
- 再生医療等製品とは、人又は動物の生きた細胞や組織を培養等の加工を施し作成されたもので、体の構造・機能の再建・修復・形成や疾病の治療・予防、遺伝子治療を目的として使用されます。金属などの材料でできた製品よりも人のからだに馴染みやすいなどの理由から、医薬品や医療機器のように用いることができます。しかし再生医療等製品を医療に用いることを目的として世に出すためには、医薬品や医療機器と同じように、非臨床試験(動物実験など)、臨床研究、治験、厚生労働省での審査、承認・販売といった順序で、いろいろなことを調べていく必要があります。
- 2)医師主導治験
- 治験のうち、治験を行う医師が自ら計画を立て行うものを「医師主導治験」といいます。医師主導治験は医師自らが、治験の計画を作成し、治験の実施から試験結果の取りまとめまで、すべての業務を実施・統括して行う治験です。医師主導治験では、外国で有効性・安全性が確立した医薬品等で、国内ではまだ承認されていない、あるいは国内で適応外使用となっているものや、大学などで開発された医薬品等の候補物質の有効性・安全性を探索することなどを目的として行われます。患者さんが医療の現場で必要性が高い医薬品等をより早く使用できるようにするために行われています。
- 3)変形性膝関節症(へんけいせい・ひざかんせつしょう)
- 関節軟骨の摩耗を特徴とする疾患で、高齢化社会を迎えた日本には2500万人いると推定されています。変形性膝関節症を発症すると、治療による完治は難しく、現状では対症療法、骨切り術、人工関節置換術以外の治療法は望めません。高齢者の自立した生活を維持するには、できる限り変形性膝関節症の発症を抑える努力が必要です。
- 4)滑膜(かつまく)
- 滑膜とは、関節を包む膜のことで、関節液を分泌することにより、関節をスムーズに動かしたり、関節にある関節軟骨と呼ばれる部位に栄養を与えたりする役割があります。
- 5)滑膜幹細胞(かつまく・かんさいぼう)
- 膝関節を包む関節包を裏打ちする膜である滑膜に由来する間葉系幹細胞。関矢らは滑膜幹細胞が自己血清で効率よく増殖すること、軟骨分化能が高いこと、動物モデルにおいて、細胞浮遊液を軟骨・半月板欠損部に10分間静置すると効率よく接着し軟骨・半月板を再生させることを報告しました。また、平成20年に半月板への応用に先立って実施した滑膜幹細胞による軟骨再生の臨床研究においても、多数の例で軟骨欠損部の再生、症状の改善を認めています。
- 6)非盲検単群試験(ひもうけん・たんぐんしけん)
- 単群試験とは、単一の介入条件のみを設定する試験で、介入前後を比較することで、その効果を検証しますが、対照条件を設けないために、介入条件以外の要因の影響を受けやすいといえます。対照群を設定する場合に、評価や解釈にバイアス(作為)が入ることを防ぐため、参加者がどの群に入るかを非公開とすることを盲検化と呼びますが、参加者、治験実施医師いずれもが参加者が受けた治療内容を知っている形で進められる試験のことを非盲検試験と呼びます。今回の治験では、単群で対照群を置かない非盲検単群試験として実施します。
お問い合わせ先
患者さん等からの治験に関するお問い合わせ先
東京医科歯科大学大学 統合研究機構 再生医療研究センター
関矢 一郎(セキヤ イチロウ)
TEL:03-5803-4017 FAX:03-5803-0192
E-mail:saisei01.arm“AT”tmd.ac.jp
報道関係からのお問い合わせ先
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5833 FAX:03-5803-0272
E-mail:kouhou.adm“AT”tmd.ac.jp
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 再生医療研究課
TEL:03-6870-2220 FAX:03-6870-2243
E-mail:saisei3“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成29年7月29日
最終更新日 平成29年7月29日


