プレスリリース 脂質分子LPAを受容する膜受容体の構造を解明 ―乏毛症やがん治療薬の創出につながる基盤情報が明らかに―
プレスリリース
国立大学法人東北大学
国立研究開発法人日本医療研究開発機構
発表者
井上飛鳥 (東北大学大学院薬学研究科 准教授)
青木淳賢 (東北大学大学院薬学研究科 教授)
濡木 理 (東京大学大学院理学系研究科生物科学専攻 教授)
発表のポイント
- 生体内で情報伝達物質として機能する脂質分子「リゾホスファチジン酸(LPA)」の受容体であるLPA6の立体構造を解明した。
- LPA6の立体構造と生化学的な実験に基づき、LPA6がLPA分子を認識する仕組みを明らかにした。
- LPA6が毛髪形成や血管形成に関与していることから、これらの経路を標的とする薬剤の合理的な設計が可能となることが期待される。
発表概要
ヒトを含め多細胞生物の体を構成する細胞は、周囲の環境中の多様な情報を受け取り、細胞内で適切な応答を起こすことで環境に適応します。この細胞外から細胞内への情報伝達は、細胞の表面に埋まっている様々な受容体タンパク質が特定の情報伝達物質と結合することで行なわれます。脂質の一種であるリゾホスファチジン酸(LPA)は情報伝達物質の1つであり、これに結合するLPA受容体が6種類知られています。今回、東京大学大学院理学系研究科の濡木教授らのグループは、東北大学大学院薬学研究科の青木教授のグループなどとの共同研究のもと、LPA受容体の1つであるLPA6の立体構造をX線結晶構造解析(注1)により決定しました。さらに、立体構造情報に基づく変異体解析(注2)により、LPA分子はLPA6が受容体側面に持つ溝にはまり込んで認識される、という予想外の仕組みを明らかにしました。LPA6は先天性乏毛症と呼ばれる毛髪疾患に関わることが知られており、がん組織などでの血管形成に関与することも示唆されています。今回のLPA6の構造情報は、LPA6を標的とする薬剤開発の基礎となる情報を提供し、将来的な先天性乏毛症治療薬や抗がん剤の創薬開発研究を大きく進展させるものになると期待されます。
本研究は、AMEDの革新的先端研究開発支援事業(AMED-CREST)「炎症の慢性化機構の解明と制御に向けた基盤技術の創出」研究開発領域における研究開発課題「慢性炎症による疾患発症機構の構造基盤」(研究開発代表者:濡木 理)及び革新的先端研究開発支援事業(AMED-CREST)「疾患における代謝産物の解析および代謝制御に基づく革新的医療基盤技術の創出」研究開発領域における研究開発課題「疾患関連リゾリン脂質の同定と医療応用」(研究開発代表者:青木 淳賢)の一環で行われました。なお、本研究開発領域は、平成27年4月の日本医療研究開発機構の発足に伴い、国立研究開発法人科学技術振興機構(JST)より移管されたものです。また、本研究は、創薬等ライフサイエンス研究支援基盤事業(創薬等支援技術基盤プラットフォーム事業)の支援により行われました。
本研究成果は日本時間2017年8月10日午前2時(英国時間2017年8月9日18時)に英国科学雑誌 Natureオンライン版に掲載されます。
発表内容
生体内では様々な物質が細胞間での情報伝達物質として機能しており、これらが細胞表面に存在する受容体と結合し、受容体を活性化することで細胞外から細胞内へと情報が伝わります。このような情報伝達の入り口として機能する受容体は様々な薬剤の標的となっており、受容体の立体構造にうまくはまり込む化合物を開発することが創薬研究においては不可欠です。故に、受容体の立体構造を明らかにし、受容体が情報伝達物質を認識する仕組みを詳細に理解することは、基礎研究のみならず創薬研究にとっても非常に有益です。
リゾホスファチジン酸(LPA)は情報伝達物質として機能する脂質分子であり、負電荷を帯びた頭部と疎水的な炭化水素鎖により構成されています(図1)。LPA分子は細胞表面に存在するGタンパク質共役型受容体(注3)と呼ばれるタイプの膜受容体により認識されることが知られており、現在、6種のLPA受容体(LPA1-LPA6)が同定されています。LPA分子はこれらの受容体を介し細胞の増殖や細胞の移動など様々な細胞応答を引き起こします。LPA受容体の中でもLPA6は毛髪形成に関わることが知られており、この経路が先天的に機能しない場合は不十分な毛髪形成や毛髪の強い縮れなどの症状が現れる、先天性乏毛症と呼ばれる遺伝性疾患が引き起こされます。日本の先天性乏毛症患者の大半では、LPA6にLPA分子を供給するLPA産生酵素の機能が欠失しており、その患者数は約1万人程度と推定されています。従って、LPA分子に代わってLPA6を活性化する薬剤は先天性乏毛症の治療薬となることが期待されています。また、LPA6は血管を構成する内皮細胞にも発現しており、胎児期やがん組織における血管形成に関与することが示唆されています。このことから、LPA6の活性化を阻害する薬剤は将来的にがん治療薬となり得る可能性があります。このように、薬剤開発の標的タンパク質として注目される一方で、LPA6がどのような仕組みでLPA分子を認識しているのか、は分かっておらず、故にLPA6を標的とする効率的な薬剤開発は行われていませんでした。
そこで東京大学大学院理学系研究科の濡木教授らのグループは、X線結晶構造解析の手法を用いて、ヒトLPA6と80%程度の配列類似性を持つゼブラフィッシュ由来LPA6の立体構造を、LPA分子が結合していない状態で決定しました(図2)。LPA6の立体構造の中央には、細胞の外側に向かって大きく開いたポケットが形成されており、ここにLPA分子が収容されると予想されました。加えて、LPA6は受容体側面にも脂質膜中に向かって開いた細長い溝を持っており、これは受容体中央のポケットともつながっていました。このようなLPA6の特徴的な構造とLPA分子の化学構造に基づき、細長い溝にLPA分子の炭化水素鎖が、中央のポケットに負電荷を帯びた頭部が収容されるという、LPA6によるLPA分子認識のモデルが予想されました。東京大学大学院薬学系研究科の大和田教授らのグループとの共同研究により行ったLPA分子のドッキングシミュレーション(注4)でも、この予想に合致するLPA分子の結合様式が確認されました(図2)。また、東北大学大学院薬学研究科の青木教授らのグループとの共同研究により網羅的な変異体解析を行うことで、シミュレーションで得られたLPA分子の結合様式を実験的に検証し、LPA分子の認識に関わるアミノ酸残基の特定に成功しました。以上のような多面的な解析により、LPA分子の頭部は受容体中央のポケット内で4つの正電荷を帯びたアミノ酸残基により認識され、LPA分子の炭化水素鎖は受容体側面の溝の内部で、溝が作り出す形状に対するはまり込みやすさで認識される、というLPA分子の認識機構を提唱しました(図3)。また、他の受容体の立体構造との比較から、LPA分子頭部の認識に伴い誘起される立体構造の変化が受容体の活性化に重要である可能性が示唆されました。
従来、膜受容体は中央に形成されたポケットの中で情報伝達物質を認識すると考えられており(図4)、これまでに報告された多数の膜受容体の立体構造からもその考えが支持されていました。本研究で提唱された受容体側面の溝を用いてのLPA分子の炭化水素鎖の認識機構は、この従来の考え方からは予想できなかった完全に新規な仕組みであり、膜受容体の立体構造の多様性について新たな知見を与える画期的なものです。また、LPA分子を始めとする脂質の情報伝達物質は細胞膜に埋まった状態で多く存在しますが、それらがどのような経路で受容体中央のポケットに入り込むのか、明確には分かっていませんでした。今回、LPA6が持つポケットが細胞外側に加えて脂質膜側に対しても大きく開いていることが分かった事で、脂質膜中のLPA分子が受容体の側面からポケットに入り込むことが可能であることが示されました。これにより、他の脂質性の情報伝達物質の、受容体に対する入り込み方についても理解が大きく進むと期待されます。加えて、このユニークなLPA分子の認識機構と、受容体の活性化に重要な立体構造の変化に関する示唆は、LPA6標的化合物の合理的な設計への道を切り開くものとして有用です。LPA6は比較的近年同定された受容体であり、その生理機能についての基礎研究も薬剤開発を目指しての創薬研究も十分に進んでいません。本研究によりLPA6の立体構造とLPA分子の認識機構についての理解が飛躍的に深まったことで、LPA6を標的とする薬剤候補化合物の探索と改変の試みが今後大きく進展していくことが期待されます。
発表雑誌
- 雑誌名:
- 「Nature」(8月17日号掲載予定)
- 論文タイトル:
- Structural insights into ligand recognition by the lysophosphatidic acid receptor LPA6
- 著者:
- Reiya Taniguchi*, Asuka Inoue*, Misa Sayama, Akiharu Uwamizu, Keitaro Yamashita, Kunio Hirata, Masahito Yoshida, Yoshiki Tanaka, Hideaki E. Kato, Yoshiko Nakada-Nakura, Yuko Otani, Tomohiro Nishizawa, Takayuki Doi, Tomohiko Ohwada, Ryuichiro Ishitani, Junken Aoki* & Osamu Nureki*
- DOI番号:
- 10.1038/nature23448
用語説明
- (注1)X線結晶構造解析:
- タンパク質の立体構造を決定する手法の1つ。高純度に精製したタンパク質より調製したタンパク質の結晶に対しX線を照射し、得られた回折データを解析することでタンパク質の電子密度の情報を得ることができる。原子レベルでタンパク質の立体構造を明らかにできる手法であり、タンパク質の構造解析には最も一般的に用いられる。
- (注2)変異体解析:
- タンパク質の機能を解析する上で幅広く用いられる手法の一つ。タンパク質の機能に重要と考えられるアミノ酸残基や特定の領域についてその部分を持たない変異体を作成し、その変異体タンパク質の機能がどの程度保持されているか、を確認することで、タンパク質が機能する上で特に重要な箇所を特定できる。本研究の場合は、受容体がLPA分子に応答して活性化できるかどうか、と受容体がLPA分子に結合できるかどうか、を指標に変異体の機能を評価した。
- (注3)Gタンパク質共役型受容体:
- 膜受容体の1群。情報伝達物質を受容すると、細胞内側の立体構造を変化させてGタンパク質と呼ばれる別のタンパク質と相互作用し、これにより活性化されたGタンパク質が細胞内で様々なシグナル伝達経路へと情報を伝える、という共通した仕組みにより細胞内へと情報を伝える。ヒトでは300種を超える数のGタンパク質共役型受容体が細胞間での情報伝達において機能しており、その多くが薬剤標的として捉えられている。現在利用されている薬剤の中でも、Gタンパク質共役型受容体を標的とするものは数多い。
- (注4)ドッキングシミュレーション:
- タンパク質の立体構造と低分子化合物の分子構造に基づき、計算機上で2者の結合様式を予測するシミュレーション手法のこと。一般には、特定のタンパク質に作用する薬剤候補化合物の選定や、低分子の結合に重要な相互作用の解析などに用いられる。
添付資料
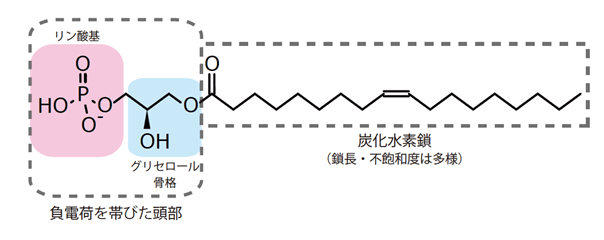 図1.LPA分子の化学構造
図1.LPA分子の化学構造
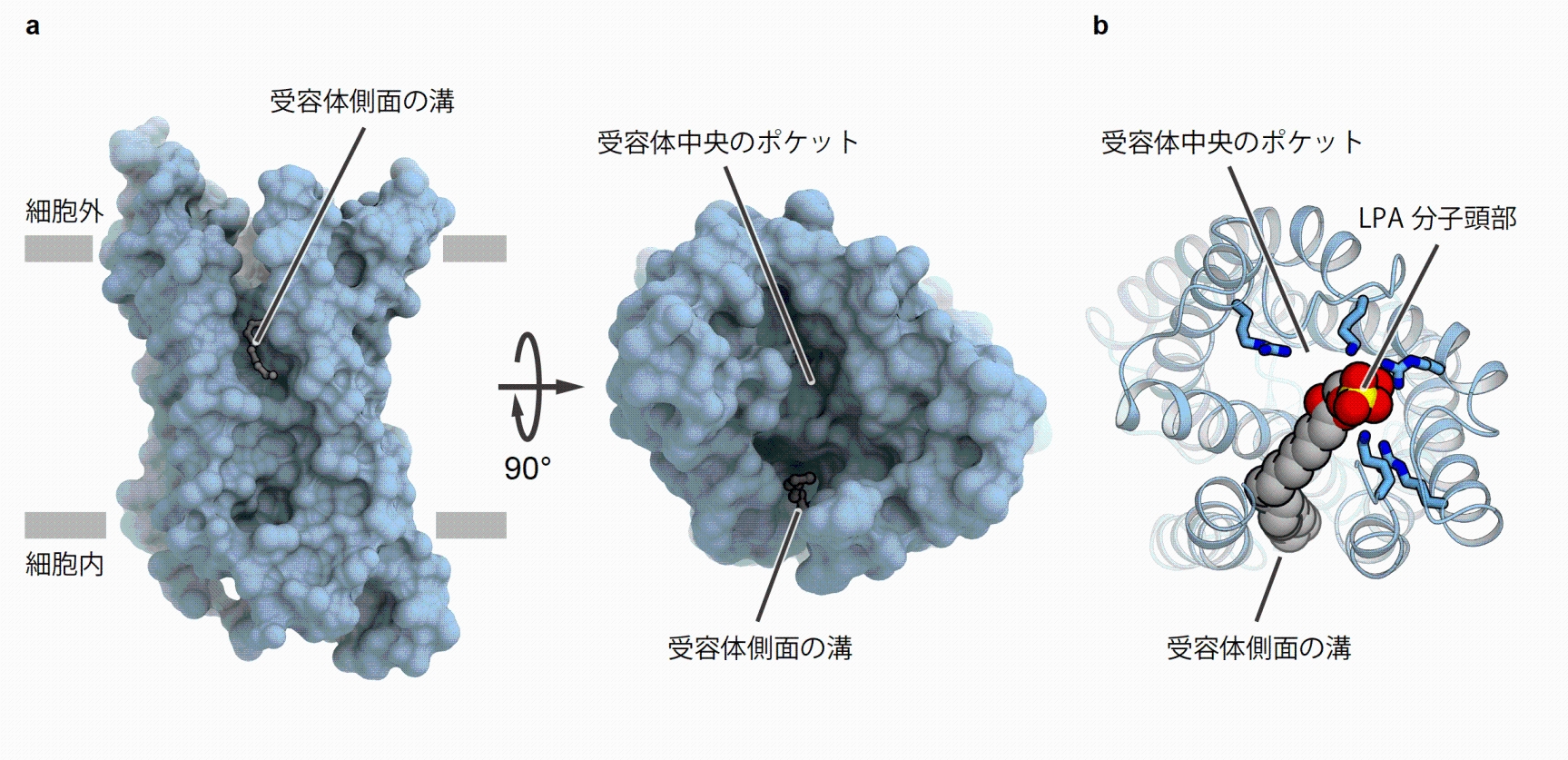
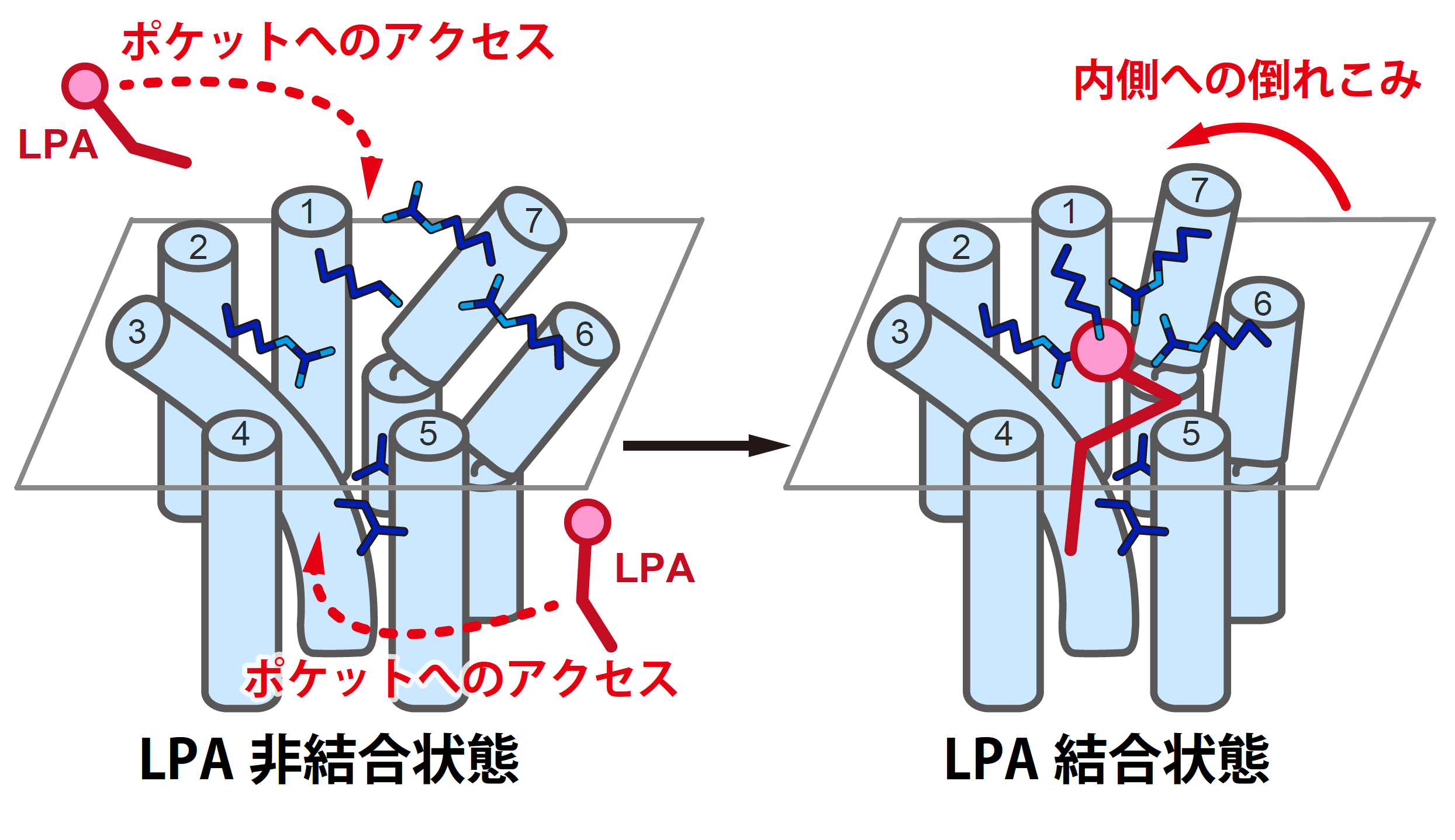
図3.本研究より提唱されたLPA分子認識機構の模式図 ピンク色の丸で示されたLPA分子の頭部が受容体中央のポケットで認識されると、それに伴い受容体の一部の領域がLPA分子に向かって倒れこむ構造変化が起こる(図中「内側への倒れこみ」に対応)。この構造変化がLPA分子の認識と受容体の活性化に重要だと予想される。
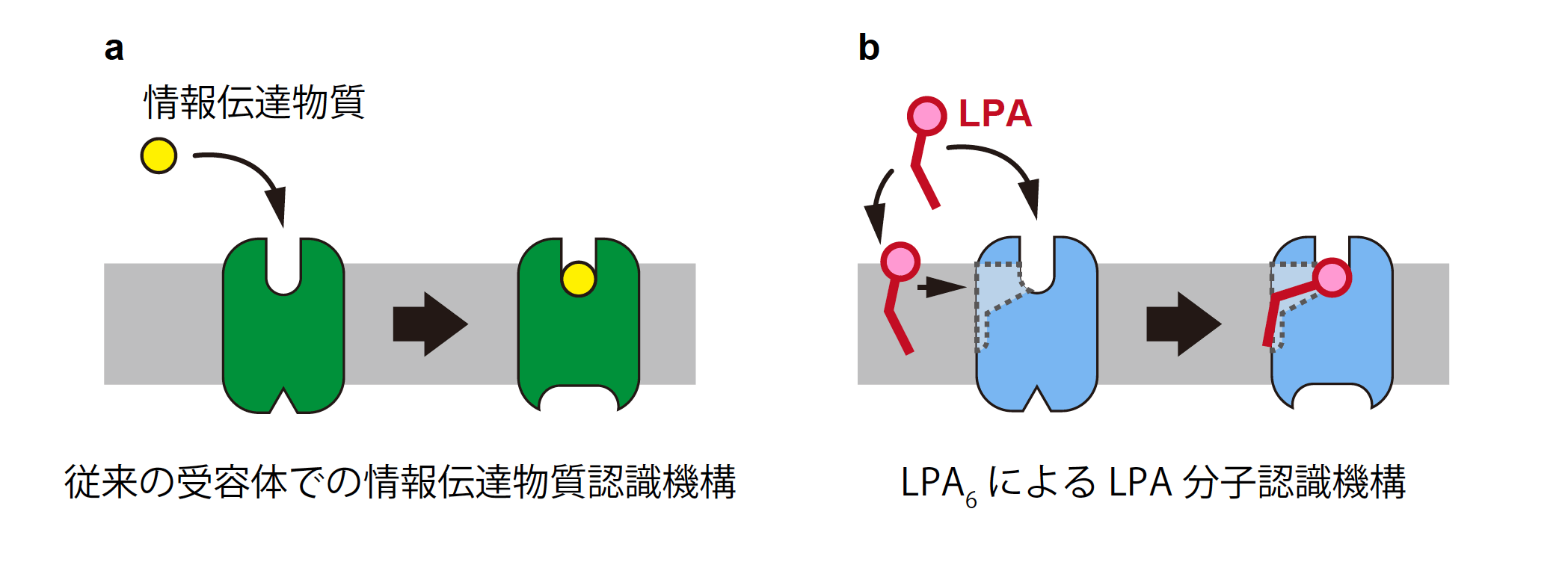
図4.受容体による情報伝達物質認識機構の比較 (a)これまでに知られていた受容体では、情報伝達物質は受容体中央のポケット内で認識されると考えられてきた。一方、(b)LPA6の場合は受容体中央のポケットと側面の溝がつながっており、LPA分子は受容体側面に沿うような形で、脂質膜中に半分露出した状態で認識される。
お問い合わせ先
研究に関すること
東京大学 大学院理学系研究科 生物科学専攻
教授 濡木 理(ぬれき おさむ)
TEL:03-5841-4392
E-mail:nureki“AT”bs.s.u-tokyo.ac.jp
東北大学 大学院薬学研究科 分子細胞生化学分野
教授 青木 淳賢(あおき じゅんけん)
TEL:022-795-6860
E-mail:jaoki“AT”m.tohoku.ac.jp
報道に関すること
東京大学 大学院理学系研究科・理学部
特任専門職員 武田 加奈子
学術支援職員 谷合 純子
教授・広報室長 大越 慎一
TEL:03-5841-0654
E-mail:kouhou.s“AT”gs.mail.u-tokyo.ac.jp
事業に関すること
革新的先端研究開発支援事業
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課
TEL:03-6870-2224 Fax:03-6870-2243
E-mail:kenkyuk-ask“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 平成29年8月10日
最終更新日 平成29年8月10日


