プレスリリース ヒトiPS細胞から分化させた肺胞上皮細胞の長期培養に成功―様々な呼吸器疾患の研究進展へ貢献―
プレスリリース
国立研究開発法人日本医療研究開発機構
概要
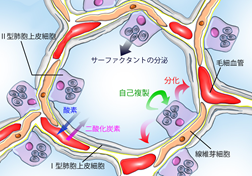 肺胞は体に必要な酸素を取り込み不要な二酸化炭素を排出するガス交換を行うための構造で、I型、II型の肺胞上皮細胞に覆われています。I型肺胞上皮細胞は平たい形をしてガスを通しやすい形をしており、II型肺胞上皮細胞は肺胞がつぶれるのを防ぐために活性物質(サーファクタント)を分泌し、自己を複製しながらI型肺胞上皮細胞にも分化できるという肺における幹細胞としての重要な役割を担っています。このII型肺胞上皮細胞の異常は、慢性閉塞性肺疾患、間質性肺炎、肺がんなどの様々な難治性呼吸器疾患とも関連すると考えられていますが、II型肺胞上皮細胞は試験管内では遺伝子発現が安定せず、長期培養が出来なかったため、研究の大きな制約となってきました。
肺胞は体に必要な酸素を取り込み不要な二酸化炭素を排出するガス交換を行うための構造で、I型、II型の肺胞上皮細胞に覆われています。I型肺胞上皮細胞は平たい形をしてガスを通しやすい形をしており、II型肺胞上皮細胞は肺胞がつぶれるのを防ぐために活性物質(サーファクタント)を分泌し、自己を複製しながらI型肺胞上皮細胞にも分化できるという肺における幹細胞としての重要な役割を担っています。このII型肺胞上皮細胞の異常は、慢性閉塞性肺疾患、間質性肺炎、肺がんなどの様々な難治性呼吸器疾患とも関連すると考えられていますが、II型肺胞上皮細胞は試験管内では遺伝子発現が安定せず、長期培養が出来なかったため、研究の大きな制約となってきました。
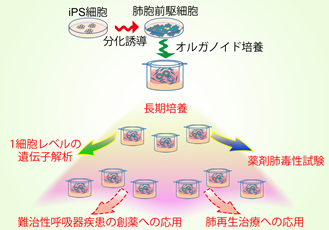 後藤慎平 医学研究科呼吸器内科特定准教授、山本佑樹 医師らは、ヒトiPS細胞から効率よくⅡ型肺胞上皮細胞を作製し、3ヶ月以上にわたって長期培養することにも成功しました。また、鈴木 穣 東京大学教授、河野隆志 国立がんセンター研究所分野長らの研究チームと共同研究を行い、ヒトiPS細胞からII型肺胞上皮細胞に分化する過程を1細胞ごとの遺伝子レベルで詳細に解析したところ、マウスの同じ細胞と似たようなパターンを取ることが分かりました。この成果はヒトにおける肺の発生様式が遺伝子レベルではまだ未解明の中、iPS細胞を使うことでヒトの肺胞がマウスと同様のパターンで発生する可能性が示唆されました。さらに研究者たちはヒトiPS細胞から分化させて長期培養したII型肺胞上皮細胞に形態異常を引き起こすことが知られる薬剤を投与し、細胞、遺伝子レベルで異常を検出する方法を開発しました。これらの実験結果から、ヒトiPS細胞は今まで困難だった薬剤による肺への副作用予測や将来の肺の再生医療、様々な難治性呼吸器疾患の創薬にも役立つことが期待されます。これらの研究成果は2017年10月2日付のNature Methodsオンライン版に掲載されました。
後藤慎平 医学研究科呼吸器内科特定准教授、山本佑樹 医師らは、ヒトiPS細胞から効率よくⅡ型肺胞上皮細胞を作製し、3ヶ月以上にわたって長期培養することにも成功しました。また、鈴木 穣 東京大学教授、河野隆志 国立がんセンター研究所分野長らの研究チームと共同研究を行い、ヒトiPS細胞からII型肺胞上皮細胞に分化する過程を1細胞ごとの遺伝子レベルで詳細に解析したところ、マウスの同じ細胞と似たようなパターンを取ることが分かりました。この成果はヒトにおける肺の発生様式が遺伝子レベルではまだ未解明の中、iPS細胞を使うことでヒトの肺胞がマウスと同様のパターンで発生する可能性が示唆されました。さらに研究者たちはヒトiPS細胞から分化させて長期培養したII型肺胞上皮細胞に形態異常を引き起こすことが知られる薬剤を投与し、細胞、遺伝子レベルで異常を検出する方法を開発しました。これらの実験結果から、ヒトiPS細胞は今まで困難だった薬剤による肺への副作用予測や将来の肺の再生医療、様々な難治性呼吸器疾患の創薬にも役立つことが期待されます。これらの研究成果は2017年10月2日付のNature Methodsオンライン版に掲載されました。
背景
研究手法・成果
1. ヒトiPS細胞から効率良くⅡ型肺胞上皮細胞を分化誘導する方法
2. オルガノイド培養を用いたヒトiPS細胞由来Ⅱ型肺胞上皮細胞の長期培養
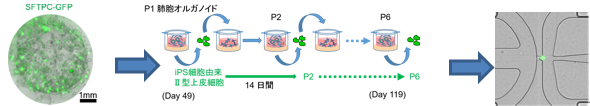 図1 (左):作成したオルガノイド。Ⅱ型肺胞上皮細胞が緑色に発光している。(中)今回開発したiPS由来Ⅱ型肺胞上皮細胞を長期培養する方法。P6では6回細胞を植え替えている。(右):1細胞ごとに分離したiPS由来Ⅱ型肺胞上皮細胞。
図1 (左):作成したオルガノイド。Ⅱ型肺胞上皮細胞が緑色に発光している。(中)今回開発したiPS由来Ⅱ型肺胞上皮細胞を長期培養する方法。P6では6回細胞を植え替えている。(右):1細胞ごとに分離したiPS由来Ⅱ型肺胞上皮細胞。
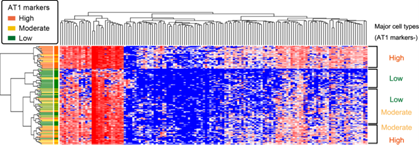 図2:遺伝子発現パターンによってiPS由来Ⅱ型肺胞上皮細胞をグループ化した図。縦軸が1個ずつの細胞、横軸が遺伝子。赤~青の表示は、遺伝子発現量の多さを示す(赤くなるほど多い)。
図2:遺伝子発現パターンによってiPS由来Ⅱ型肺胞上皮細胞をグループ化した図。縦軸が1個ずつの細胞、横軸が遺伝子。赤~青の表示は、遺伝子発現量の多さを示す(赤くなるほど多い)。
3. 長期培養したヒトiPS細胞由来Ⅱ型肺胞上皮細胞から肺胞オルガノイドを作り、薬剤肺毒性試験を可能に
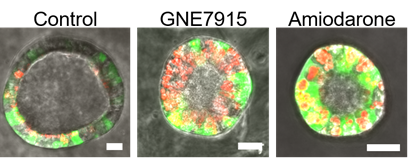 図3:薬剤投与を行ったあと、iPS由来Ⅱ型肺胞上皮細胞を細胞が生きている状態で撮影したオルガノイド。薬剤投与後のもの (中・右) では投与していないもの (左) に比べて赤色に蛍光する色素で標識されたラメラ体という構造物が異常に大きくなり増えている。
図3:薬剤投与を行ったあと、iPS由来Ⅱ型肺胞上皮細胞を細胞が生きている状態で撮影したオルガノイド。薬剤投与後のもの (中・右) では投与していないもの (左) に比べて赤色に蛍光する色素で標識されたラメラ体という構造物が異常に大きくなり増えている。
波及効果、今後の予定
研究プロジェクトについて
本研究は、下記機関より資金的支援を受けて実施されました。
日本医療研究開発機構 再生医療実現拠点ネットワークプログラム・橋渡し研究加速ネットワークプログラム、日本学術振興会 科学研究費補助金、かなえ医薬振興財団、武田科学振興財団、第一三共株式会社
論文タイトルと著者
- タイトル:
- Long-term expansion of alveolar stem cells derived from human iPS cells in organoids
- 著者:
- Yuki Yamamoto, Shimpei Gotoh, Yohei Korogi, Masahide Seki, Satoshi Konishi, Satoshi Ikeo, Naoyuki Sone, Tadao Nagasaki, Hisako Matsumoto, Shigeo Muro, Isao Ito, Toyohiro Hirai, Takashi Kohno, Yutaka Suzuki, Michiaki Mishima
- 掲載誌:
- Nature Methods
用語解説
- (注1)オルガノイド:
- ミニ臓器を培養皿の上で作成したもの。
- (注2)肺線維芽細胞:
- 肺の結合組織を作り出す細胞。分裂寿命や老化の研究、ワクチン生産に広く用いられてきた。
- (注3)CHIR99021:
- GSK3βという酵素を阻害することで細胞内のシグナル伝達経路を活性化させる低分子化合物。
- (注4)SB431542:
- TGF-βシグナル伝達経路を阻害する低分子化合物。
- (注5)アミオダロン:
- 不整脈治療に使用される薬剤。
- (注6)GNE7915:
- 一部の家族性パーキンソン病に見られる異常蛋白質を標的として開発された低分子化合物。
お問い合わせ先
後藤 慎平
大学院医学研究科 呼吸器内科/呼吸器疾患創薬講座・特定准教授
TEL:075-751-3830
E-mail:konai“AT”kuhp.kyoto-u.ac.jp
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 再生医療研究課
〒100-0004 東京都千代田区大手町一丁目7番1号
TEL:03-6870-2220 FAX:03-6870-2242
E-mail:saisei“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成29年10月3日
最終更新日 平成29年10月3日


