口腔常在菌の中には、異所性に腸管に定着すると免疫を活性化するものがいる
プレスリリース
慶應義塾大学医学部
理化学研究所
早稲田大学
国立研究開発法人日本医療研究開発機構
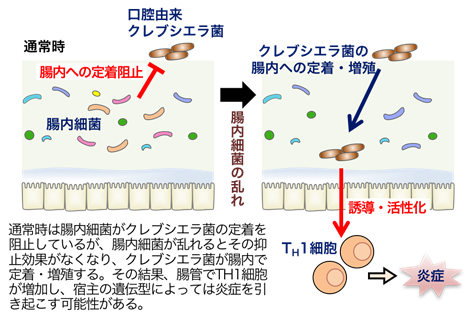
慶應義塾大学医学部の本田賢也教授(理化学研究所統合生命医科学研究センター消化管恒常性研究チームリーダー兼任)と早稲田大学理工学術院の服部正平教授らを中心とする共同研究グループは、腸内細菌叢の乱れに乗じて、口腔に存在するクレブシエラ菌が腸管内に定着することにより、TH1細胞※1と呼ばれる免疫細胞の過剰な活性化を引き起こし、炎症性腸疾患(クローン病や潰瘍性大腸炎)などの発症に関与する可能性があることをマウスを用いて示しました(下図)。
今回の成果は、細菌を標的とした炎症性疾患の新たな予防法や治療薬、診断薬の開発につながることが期待されます。
本研究成果は、国際学術雑誌『Science』2017年10月20日(金)版に掲載されました。
論文名:Ectopic colonization of oral bacteria in the intestine drives TH1 cell induction and inflammation
発表概要
発表内容
1.背景
消化管や口腔などには多様な常在細菌が存在し、私たちの免疫系や生理機能に強い影響を与えることで、健康維持に大きな役割を果たしています。そのため、腸内に存在する様々な細菌種の数や割合の変動が炎症性腸疾患をはじめとする様々な病気の発症に関与していることが強く示唆されています。しかしながら、このような腸内細菌叢の乱れから疾患発症につながるまでのメカニズムについては、不明な点が多く残されていました。
そこで、共同研究グループは、口腔細菌が炎症性腸疾患や大腸がんなどの患者の便中に多く検出されることに注目し、口腔細菌が腸管内に定着することによる腸管免疫系への影響と病気との関わりについて研究を行いました。
2.内容
本研究では、まずクローン病※2患者の唾液を無菌マウス※3に経口投与し、そのマウスの腸管に存在する免疫細胞の種類をフローサイトメトリー※4により解析しました。この解析により、クローン病患者の口腔に存在していた細菌が腸内に定着すると、腸管免疫系にどのような影響を与えるのかを明らかにすることができます。その結果、あるクローン病患者の唾液を投与したマウスの大腸において、インターフェロンガンマ(IFN-γ)を産生するCD4陽性のヘルパーT細胞(TH1細胞※1)が顕著に増加していることを発見しました。
そこで、このクローン病患者の唾液中のどのような細菌がマウス腸内に定着していたかを把握するため、このマウスの糞便から細菌DNAを抽出し、細菌由来の16S rRNA遺伝子をシークエンスすることにより網羅的に調べました。この解析から、ナイセリア属、レンサ球菌属、ゲメラ属、ベイロネラ属、フソバクテリウム属、ビフィドバクテリウム属、アナエロコッカス属、エシェリキア属(大腸菌属)、クレブシエラ属細菌など約30種類の細菌が検出されました。次いで、これらの細菌の多くを単離・培養し、それぞれの細菌を無菌マウスへ定着させたところ、クラブシエラ属のクレブシエラ・ニューモニエ※5(Klebsiella pneumoniae)がTH1細胞を強く誘導する細菌であることを見出しました。
さらに、腸内細菌が存在している通常のSPF※6(specific pathogen-free)マウスにクレブシエラ・ニューモニエを経口投与しても腸管内にクレブシエラ・ニューモニエが定着し増殖することはありませんでしたが、アンピシリン等の抗生物質を投与したSPFマウスではクレブシエラ・ニューモニエが腸管内に定着し、TH1細胞を強く誘導することがわかりました。このことから、通常時には元々いる腸内細菌叢が口腔から入ってきたクレブシエラ・ニューモニエの腸管内への定着を阻止しているけれど、抗生物質の使用などにより腸内細菌叢が乱れるとこの定着阻害効果が弱まり、クレブシエラ・ニューモニエの腸管内への定着が引き起こされると考えられます。
次に、クレブシエラ・ニューモニエの腸管内への定着がクローン病の発症・増悪に関与しているのかを調べるため、無菌の腸炎発症モデルマウス(IL-10欠損マウス※7)にクレブシエラ・ニューモニエを経口投与し、腸管炎症の状態を解析しました。その結果、比較対象として大腸菌を投与したIL-10欠損マウスでは腸管に炎症が起こっていませんでしたが、クレブシエラ・ニューモニエを投与したIL-10欠損マウスでは強い腸管炎症が起こっていました。一方で野生型マウスにクレブシエラ・ニューモニエを経口投与しても、腸管でのTH1細胞の増加は見られるものの炎症は起こりません。このことから、クレブシエラ・ニューモニエの腸管内への定着がTH1細胞の過剰な増殖や活性化を引き起こし、宿主の遺伝型によっては炎症の惹起・増悪・遷延化につながっていることが示唆されました。また、潰瘍性大腸炎の患者の唾液を無菌マウスに投与する実験を行ったところ、一部の患者においてクローン病患者の唾液投与マウスと同様に腸管でのクレブシエラ属菌の定着とTH1細胞の増加が観察されました。さらに、健常者の唾液を用いた実験においても、腸管でのクレブシエラ・ニューモニエの定着とTH1細胞の増加が観察されました。このことから、TH1細胞を誘導するクレブシエラ属菌は炎症性腸疾患患者だけでなく健常者の口腔にも存在している可能性があることが示唆されました。そのため、例えば長期的に過剰量の抗生物質を服用した場合には健常者でも腸管へのクレブシエラ属菌の定着が起こる可能性があり、過度な抗生物質の服用には気を付けるべきだと考えられます。
3. 今後の展開
本研究では、クローン病や潰瘍性大腸炎などの慢性炎症性腸疾患の発症にクレブシエラ属細菌が関与している可能性があることを示しました。したがって、クレブシエラ属細菌が慢性炎症性腸疾患に対する新たな創薬標的となり得ます。今後は、クレブシエラ属細菌を選択的に排除・殺菌する抗生物質などの開発やクレブシエラ属細菌が腸管内に定着させないような薬剤の開発を通して、これら疾患の予防法や治療薬の開発につながることが期待されます。
4.特記事項
今回の研究の一部は、下記に示す国立研究開発法人日本医療研究開発機構の革新的先端研究開発支援事業(AMED-CRESTおよびLEAP)における研究開発の一環として行われました。
- 1)AMED-CREST
- 研究開発領域:「生体恒常性維持・変容破綻機構のネットワーク的理解に基づく最適医療実現のための技術創出」(研究開発総括:永井良三)
研究開発課題名:「腸内常在細菌特性理解に基づく難治性疾患新規治療法の開発」
研究開発代表者:本田賢也
実施期間:平成24年度から平成28年度
※本研究開発領域は、平成27年4月の日本医療研究開発機構の発足に伴い、国立研究開発法人科学技術振興機構(JST)より移管されました。
- 2)LEAP(インキュベートタイプ)
- 研究開発課題名:「腸内細菌株カクテルを用いた新規医薬品の創出」
研究開発代表者:本田賢也
実施期間:平成28年度から平成32年度
5.論文
- タイトル:
- “Ectopic colonization of oral bacteria in the intestine drives TH1 cell induction and inflammation”
(口腔由来細菌の腸管内定着によって引き起こされるTH1細胞と炎症誘導メカニズムの解明) - 著者名:
- 新幸二、須田亙、Chengwei Luo、河口貴昭、元尾伊織、成島聖子、木口悠也、安間恵子、渡辺栄一郎、田之上大、Christoph A. Thaiss、佐藤繭子、豊岡公徳、Heba S. Said、山上博一、Scott A. Rice、Dirk Gevers、Ryan C. Johnson、Julia A. Segre、Kong Chen、Jay K. Kolls、Eran Elinav、森田英利、Ramnik J. Xavier、服部正平、本田賢也
- 掲載誌:
- 『Science』2017年10月20日オンライン版
用語解説
- ※1 TH1細胞
- CD4陽性のヘルパーT細胞の一種で、主にインターフェロンガンマ(IFN-γ)を産生します。IFN-γはマクロファージを活性化し、その殺菌作用を強化します。主に細胞内寄生細菌の感染防御に重要な役割を担っていますが、過剰な活性化は自己免疫疾患の発症につながるため適切な制御が必要です。
- ※2 クローン病
- 口から肛門にいたる消化管に非連続性に炎症・潰瘍ができる病気。回腸の末端にもっとも好発します。活動期と寛解期を繰り返し、その過程で腸が狭くなり狭窄を起こし、腸閉塞を起こすこともあります。まだ病因は明らかになっていませんが、遺伝的な素因、免疫系の異常、腸内細菌や食事などの環境要因が複合的に組み合わさって起こると考えられています。
- ※3 無菌マウス
- 無菌状態で飼育できる特殊な環境(アイソレーター)内で飼育したマウスで、腸内細菌や皮膚などの常在細菌を含め、検出可能な微生物をまったく持たないマウス。常在細菌をもたないため、生理学的、免疫学的にいくつかの異常がみられますが、健康な状態を維持しています。
- ※4 フローサイトメトリー
- 一つの細胞の複数の分子(主にタンパク質)を同時かつ高速に測定し、複数種類の細胞の分布を解析する装置。細胞表面または内部の分子を蛍光物質で標識した後、細胞一つずつに一定波長のレーザー光を当てた時に生じる蛍光波長を検出することにより、その細胞が何の分子を持っているかを分析します。ある部位に存在する細胞集団の増減や機能分子の発現量の増減を解析するために利用されています。
- ※5 クレブシエラ・ニューモニエ(Klebsiella pneumoniae)
- グラム陰性の桿菌で、肺炎桿菌とも呼ばれます。ヒトの口腔や腸内に常在していますが、通常は病気を引き起こすことはありません。しかし、免疫系が弱っている人や高齢者、糖尿病患者などでは、肺炎や気管支炎、膀胱炎など日和見感染症を引き起こすことがあります。
- ※6 SPFマウス
- 研究で用いられるマウス飼育施設の基準を満たした清潔な環境で飼育され、病気を引き起こす病原体(specific pathogen)がいない(free)マウス。腸内や皮膚には常在細菌が存在しています。
- ※7 IL-10欠損マウス
- 免疫系を抑制する機能をもつインターロイキン(IL)-10を遺伝的に働けなくしたマウス。このマウスでは免疫系の抑制が不十分なため、SPF環境で飼育すると自然に腸炎を発症します。しかし、無菌環境で飼育すると腸炎の発症は見られません。そのため、IL-10欠損マウスの腸炎の発症には腸内細菌の存在が必要であることがわかっていますが、どのような細菌種が炎症惹起に関与しているかはこれまであまりよく分かっていませんでした。
お問い合わせ先
研究内容について
慶應義塾大学医学部微生物学・免疫学教室
教授 本田 賢也(ほんだ けんや)
TEL:03-5363-3769 FAX:03-5361-7658
E-mail:kenya“AT”keio.jp
早稲田大学 理工学術院 先進理工学研究科
教授 服部 正平(はっとり まさひら)
TEL:03-5286-3382(早稲田大学)または04-7136-4070 (東京大学)
E-mail:m-hattori“AT”aoni.waseda.jp
報道について
慶應義塾大学信濃町キャンパス 総務課:鈴木・山崎
〒160-8582 東京都新宿区信濃町 35 番地
TEL:03-5363-3611 FAX:03-5363-3612
E-mail:med-koho“AT”adst.keio.ac.jp
理化学研究所 広報室 報道担当:
〒351-0198 埼玉県和光市広沢2-1
TEL:048-467-9272 FAX:048-462-4715
E-mail:ex-press“AT”riken.jp
早稲田大学広報室広報課:
〒169-8050 東京都新宿区戸塚町1-104
TEL:03-3202-5454 FAX:03-3202-9435
E-mail:koho“AT”list.waseda.jp
事業に関すること
(革新的先端研究開発支援事業)
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課
TEL:03-6870-2224
E-mail:kenkyuk-ask“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
共同研究グループ
掲載日 平成29年10月20日
最終更新日 平成29年10月20日


