プレスリリース 3つの小分子化合物を用いてヒトiPS細胞の分化能力を促進する基盤技術を開発―病態モデルにおける分化成熟・老化を促進、iPS細胞株選別を不要に―
プレスリリース
慶應義塾大学医学部
順天堂大学大学院医学研究科
国立研究開発法人日本医療研究開発機構
このたび、慶應義塾大学医学部生理学教室の岡野栄之教授、順天堂大学大学院医学研究科ゲノム・再生医療センターの赤松和土特任教授らの共同研究チームは、ヒト多能性幹細胞に3つの小分子化合物を加えて、その分化能力を促進する基盤技術を開発しました。
多能性幹細胞(ES細胞・iPS細胞(注1))は、体のあらゆる組織や細胞に分化可能な細胞株であり再生医療など幅広い活用が期待されています。しかしながら、ヒト多能性幹細胞、とくにiPS細胞は、①細胞株ごとの分化効率にばらつきがある、②分化速度が比較的ゆっくりである、という性質を有しているため、目的とする細胞・組織に分化しやすい多能性幹細胞株を事前に選別する必要があり、たとえ選別された細胞株を用いたとしても高効率な分化誘導を実現するには多大な労力と長期間を要するという点に問題がありました。
今回、共同研究チームはSB431542・Dorsomorphin・CHIR99021の3種の化合物を細胞株の培地に5日間添加すると、ヒト多能性幹細胞が平面的に分化促進された状態へと、ごく短期間で誘導されることを発見しました。これら3つの小分子化合物を用いて誘導された状態を“CTraS(シトラス)”と定義し、CTraS誘導を経た細胞は、目的細胞への分化効率・速度ともに大きく上昇し、疾患モデルにおける病態発現を短期間で再現できることを発見しました。一方で、CTraSは、特定の細胞に分化しにくい株であっても目的細胞(本研究では神経細胞)へと高効率に分化させるため、目的の細胞に分化しやすい細胞株を選別することが不要になり、大きく研究効率が上昇しました。
この研究により開発されたCTraSを介した分化促進は多様な細胞系譜に応用可能であるため、ヒト多能性幹細胞を用いたあらゆる応用技術に寄与し、特に、再生医療・病態研究・医薬品開発を加速度的に促進させる基盤になると期待されます。
本研究成果は2017年10月26日正午(米国東部時間)に、国際幹細胞学会(ISSCR)の公式ジャーナルである「Stem Cell Reports」のオンライン版に掲載されました。
研究の背景と概要
多能性幹細胞(ES細胞・iPS細胞)は、体のあらゆる組織や細胞に分化可能な多能性を持った細胞株であり、再生医療や病態研究など幅広い活用が期待されています。このような応用を実現化するためには、目的とする細胞種・組織へと迅速かつ高効率に分化誘導する技術の確立が必要不可欠です。しかしながら、ヒト多能性幹細胞、とくにiPS細胞は、培養皿中での分化誘導速度が比較的ゆっくりであることに加え、たとえ同じドナーから作製した細胞株であっても、細胞株ごとの分化効率にばらつきがあるという性質を有しています。
多くの種類の細胞では、多能性幹細胞からの分化過程の第一歩として、さまざまな種類の細胞を含む胚様体(EB)(注2)と呼ばれる浮遊構造物(3次元培養)を形成させます。そこから目的の細胞種に最適な培養方法を用いることによって目的の細胞を得るという方法が広く使われています。
しかし、この方法の難点は、多能性幹細胞の分化のばらつきによって、細胞株によっては目的の細胞を生み出す「もと」となる細胞が少ないために、それ以降、分化・誘導等培養が成功しないケースが多く認められていました。このため、さまざまな種類の細胞に分化誘導をする際に、細胞株によって目的の細胞に効率よく分化しないことがあり、また、分化誘導に数十日以上と非常に長い時間がかかることが、研究の効率を大きく低下させていました。さらに、特に新しく体細胞(血液や皮膚の細胞など)からiPS細胞を樹立する際には、分化のしやすさが異なるそれぞれの株の中から目的とする細胞・組織に分化しやすい細胞株を事前に選別する必要があり、たとえ選別された細胞株を用いたとしても目的細胞・組織へと誘導するには極めて多大な労力と長時間を要することがあるという点に問題がありました。
研究の成果と意義
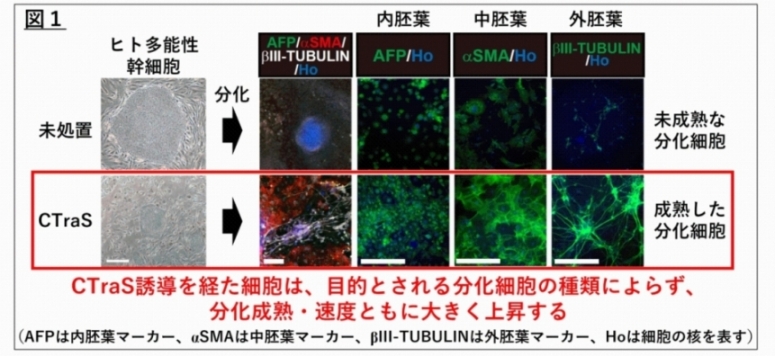
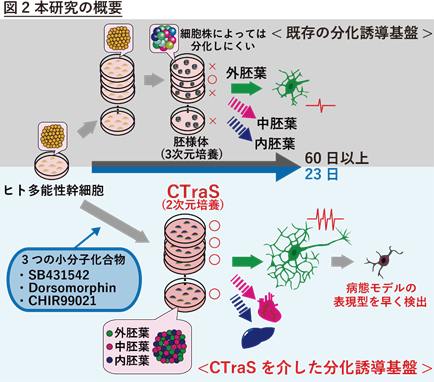
今後の展開
CTraSを介した分化誘導技術の開発は、多能性幹細胞を用いた疾患研究の研究効率の上昇と移植医療における安全性の向上を実現する基盤技術としての活用が期待されます。
特記事項
論文
- タイトル:
- Escape from Pluripotency via Inhibition of TGF-β/BMP and Activation of Wnt Signaling Accelerates Differentiation and Aging in hPSC Progeny Cells
- 日本語訳:
- TGF-β/BMPシグナル阻害とWntシグナル活性化を介した多能性保持機構からの脱出は、ヒト多能性幹細胞由来モデルにおける分化成熟・老化を加速させる
- 著者名:
- 藤森康希、松本拓也、木佐文彦、服部信孝、岡野栄之、赤松和土
- 掲載誌:
- 「Stem Cell Reports」オンライン版
用語説明
- (注1)人工多能性幹細胞(iPS 細胞)(Induced pluripotent stem cell:iPS cell):
- 2006 年に、京都大学の山中伸弥教授らのグループによって世界で初めて作成された細胞のことで、2007 年にヒトでも同様の細胞が作製されました。この細胞は、皮膚組織などの体細胞に Oct4, Sox2, Klf4, c-Mycといった転写因子を導入することで作成され、体のあらゆる組織や細胞に分化可能な多能性を獲得します。この技術は、ヒトの細胞を用いた研究が困難であった分野に新たな研究手法を生み出しました。また、拒絶反応のない移植細胞として利用することもでき、再生医療の分野では大きく注目されています。
- (注2)胚様体(Embryoid body:EB):
- 多能性幹細胞を浮遊状態で培養を続けると、球状の細胞塊を形成し、様々な細胞間の相互作用がおき、胚発生初期にみられる3胚葉(内胚葉、中胚葉、外胚葉)への分化が誘導されます。この細胞塊を胚様体といいます。胚様体には各成熟細胞や組織の基になる未成熟な細胞が豊富に混在していることから、多能性幹細胞を用いた分化誘導研究の基礎的な手法として頻繁に使用されています。
お問い合わせ先
本発表資料のお問い合わせ先
慶應義塾大学医学部 生理学教室
教授 岡野 栄之(おかの ひでゆき)
TEL : 03-5363-3746 FAX : 03-3357-5445
E-mail:hidokano“AT”a2.keio.jp
順天堂大学大学院医学研究科
ゲノム・再生医療センター
特任教授 赤松 和土(あかまつ わど)
TEL:03-5802-1728 FAX:03-5802-8776
E-mail:awado“AT”juntendo.ac.jp
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構
戦略推進部 再生医療研究課
TEL:03-6870-2220
E-mail:saisei“AT”amed.go.jp
本リリースの発信元
慶應義塾大学
信濃町キャンパス総務課 : 鈴木・山崎
〒160-8582 東京都新宿区信濃町35
TEL:03-5363-3611 FAX:03-5363-3612
E-mail : med-koho“AT”adst.keio.ac.jp
順天堂大学
総務局 総務部 文書・広報課:長嶋
〒113-8421 東京都文京区本郷2-1-1
TEL:03-5802-1006 FAX:03-3814-9100
E-mail : pr“AT”juntendo.ac.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成29年10月27日
最終更新日 平成29年10月27日


