正常組織で発がんリスクを正確に診断する測定法を開発―ライフスタイルと発がんリスクとの関係も明らかに―
プレスリリース
国立研究開発法人国立がん研究センター
国立研究開発法人日本医療研究開発機構
研究成果のポイント
- 正常組織に蓄積され、発がんリスクとなる微量の突然変異の新たな測定法を開発した
- 食道では、発がんリスクの上昇に応じて、突然変異とDNAメチル化異常の両方が、胃では主にDNAメチル化異常が増加していることを発見した
- 食道では喫煙や過度の飲酒により、胃ではピロリ菌感染により、正常組織でも既に突然変異が増加していることが示された
- ライフスタイルに応じて蓄積した突然変異とDNAメチル化異常を測定することで、正確な新しい発がんリスク診断に発展すると期待される
概要
国立研究開発法人国立がん研究センター(理事長:中釜斉、東京都中央区)は、これまで測定困難であった正常組織に蓄積された微量の点突然変異の測定法の開発に成功しました。この新たな測定法を用いて正常な胃と食道での点突然変異とDNAメチル化異常(以前に開発した方法により測定)両者の蓄積量を測定し、発がんリスクとの関連を調べました。
この結果、発がんリスクに応じて点突然変異とDNAメチル化異常の両者または一方の蓄積が増加すること、胃と食道ではその重要性が異なることを発見しました。また、この異常の蓄積は食道では喫煙や飲酒、胃ではピロリ菌感染などライフスタイルを反映していると考えられました。さらに、点突然変異とDNAメチル化異常を測定することにより、正確な発がんリスクの予測が可能であることが分かりました。
がんになる前の正常組織で正確に発がんリスクを予測できるようになることは、検診の頻度等を適正化するとともに、早期発見・早期治療にもつながります。今後、本研究成果を応用し、様々ながんでのライフスタイルに応じた異常の蓄積の検討を進めることで、がんのリスク診断の発展が期待されます。
現在、胃がんにおいては、ピロリ菌除菌後の健康人を対象にしたDNAメチル化異常の測定によるリスク診断の臨床研究が進んでおり、5年後の実用化を目指しています。
本研究は、国立がん研究センター研究所エピゲノム解析分野(牛島俊和分野長)の研究グループによるもので、国立研究開発法人日本医療研究開発機構(AMED)の革新的がん医療実用化研究事業および次世代がん医療創生研究事業の支援を受け行いました。また、研究成果は米国科学アカデミーの機関誌である「Proceeding of National Academy of Sciences」に掲載されました。
DNAメチル化異常と点突然変異について
DNAメチル化は、遺伝子を使用する・しないの目印として細胞が利用している情報です。その異常(DNAメチル化異常)には、遺伝子の暗号と言える塩基配列が変化していないにもかかわらず遺伝子を使えなくなる効果があることが知られています。DNAメチル化異常は、ピロリ菌感染などの慢性炎症や喫煙により正常な組織に生じ、蓄積され、発がんの原因となります。ピロリ菌感染に関しては、除菌を行うことで胃粘膜のメチル化異常の程度はある程度低下しますが、完全には無くなりません。、研究グループはこの残ったメチル化異常の程度が発がんリスクと相関することも以前に解明しました。
突然変異は、タバコ・カビ毒・肉や魚の焦げ・放射線等により誘発される塩基配列(遺伝子暗号の変化)です。その結果、遺伝子の働きが永久に変化してがんの原因となることが、よく知られています。しかし、がんになる前の正常組織での突然変異の蓄積量は極めて微量であるために、これまではヒトでは測定が極めて困難でした。今回、発がんの原因であることがよく知られる突然変異のうち、主なタイプである点突然変異(1つの塩基の変異)について、研究グループは正常な組織での蓄積を測定可能にしました。
背景
多くの成人のがんは、加齢やライフスタイル(喫煙、飲酒、ピロリ菌感染の有無など)による点突然変異とDNAのメチル化異常とが蓄積することで発症します。これらの異常は、がんになる前の正常な組織に蓄積されていますが、その量は微量であり測定が困難でした。そのような中、2006年に国立がん研究センター研究所エピゲノム解析分野がDNAメチル化異常の蓄積の測定に成功、発がんリスクとの関連を解明しました。その後、2008年から臨床研究を実施し、胃粘膜に蓄積したDNAメチル化異常の量が多いと、胃がんの内視鏡治療後、別の胃がんが発生するリスクが3倍高まることを、2016年に明らかにしました。
しかし、微量の点突然変異の蓄積は測定困難な状況が続いており、その開発に向け同研究分野では測定法の開発を進めてきました。2017年、DNAサンプル調整のごく簡単な工夫により次世代シークエンサーの精度が低い部分を克服、105個の塩基あたり1個の異常も測定可能とする新たな方法を開発しました(Yamashita et al, Cancer Lett, 403:152, 2017)。
参考
2016年12月21日
研究手法
新たな測定方法を用いて、ライフスタイルをもとに①発がんリスクがほぼない人、②リスクがややある人、③リスクが高い人、それぞれの正常な食道と胃粘膜での点突然変異とDNAメチル化異常の蓄積を測定しました。
①発がんリスクがほぼない人:
食道 30人(喫煙歴、飲酒歴、噛みタバコ(ビンロウ)使用歴がない人。男20人、女10人)
胃 32人(ピロリ菌の感染が今までなかった人。男18人、女14人)
②リスクがややある人:
食道 32人(喫煙歴、飲酒歴、噛みタバコ(ビンロウ)使用歴があるが、がんには罹っていない人。男32人、女0人)
胃 32人(ピロリ菌の感染歴があるが、がんには罹っていない人。男22人、女10人)
③リスクが高い人:
食道 31人(喫煙歴、飲酒歴、噛みタバコ(ビンロウ)使用歴があり、がんに罹った人。男31人、女0人)
胃 32人(ピロリ菌の感染があり、がんに罹った人。男25人、女7人)
研究結果
食道では発がんリスクが高いほど、点突然変異とDNAメチル化異常の両者とも蓄積量が増加することを確認しました。一方、胃では発がんリスクが高いほどDNAメチル化異常の蓄積量は増加しましたが、点突然変異の増加と発がんの関連は確認できませんでした(図1)。
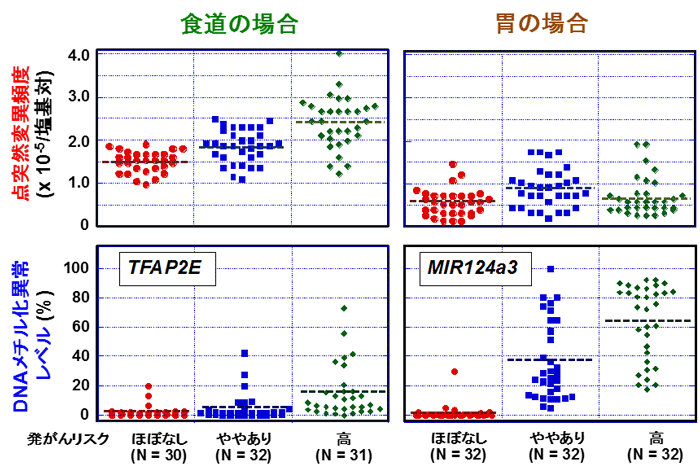
図1 発がんリスクと点突然変異及びDNAメチル化異常の蓄積増加の関連
②点突然変異やDNAメチル化異常の上昇はライフスタイルを反映
食道がんの場合、喫煙、飲酒、そして今回共同研究を行った台湾ではビンロウ使用が、誘発要因として知られています。喫煙、飲酒、ビンロウは突然変異とDNAメチル化異常の両者を誘発しますので、点突然変異とDNAメチル化異常が同じ程度に重要という食道での結果とよく合います。胃がんの場合、その誘発要因としてピロリ菌感染歴が知られています。ピロリ菌感染は胃粘膜に強い慢性炎症を誘発して、その結果、DNAメチル化異常を強力に誘発します。胃がんではDNAメチル化異常が重要という結果とよく合います(図2)。

図2 発がん誘発要因と点突然変異とDNAメチル化異常の相対的重要度
③点突然変異とDNAメチル化異常の蓄積を組み合わせることで正確なリスク診断へ
これまでは、正常な組織に蓄積したDNAメチル化異常のみが測定可能でしたので、点突然変異と組み合わせることにより発がんリスク予測精度がより向上することが考えられます。食道がんの場合、点突然変異とDNAメチル化異常を組み合わせると、発がんリスク予測の感度・特異度が非常に高くなりました。胃がんの場合、DNAメチル化異常のみの場合でも相当に高く、点突然変異追加の効果は不明確でした(表1)。
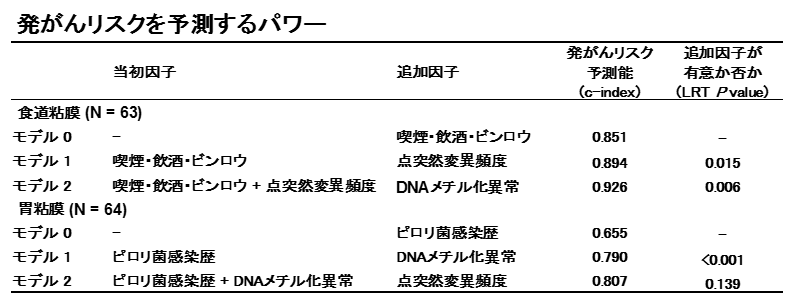
表1 ライフスタイル因子に点突然変異やDNAメチル化異常の蓄積を追加することによる予測能向上
(c-indexが1に近づくほど正確に予測できるということ)
食道がん予防のためには、点突然変異とDNAメチル化異常両者を抑制するために禁煙、減酒することが重要であると言えます。また、胃がん予防においては、DNAメチル化異常を誘発するピロリ菌の感染防止と除菌が重要であると言えます。
胃がんリスク診断の臨床研究について
研究グループでは、ピロリ菌を除菌した健康人でも正常胃粘膜に蓄積したDNAメチル化異常は残り、その蓄積量により胃がん発生リスクが高まることを確認しています。これをリスク診断に応用し臨床での実用化を目指し、現在、ピロリ菌除菌後の健康人を対象に、正常胃粘膜のDNAメチル化異常の程度の測定により胃がん発生リスクを予測する多施設共同前向き臨床研究を全国67施設の参加で行っています。2,000人の方にご協力頂く予定で、2017年12月現在、1,479人の方にご参加頂いています。
今後の展望
本研究成果により、正常組織に蓄積した点突然変異とDNAメチル化異常の両者を測定し、検討することで、より正確に発がんリスクの診断が可能となることが示されました。
現在進行中の胃がんリスク診断法の臨床実用化の一層の加速と、今後様々ながんでライフスタイルに応じた両者の異常の蓄積を検討することで、さらに多くのがんリスク診断の発展が期待されます。
発表論文
- 雑誌名:
- Proceeding of National Academy of Sciences
- タイトル:
- Genetic and epigenetic alterations in normal tissues have differential impacts on cancer risk among tissues.
- 著者:
- 山下聡、岸野貴賢、高橋崇真、島津太一、Hadrien Charvat、角川康夫、中島健、Yi-Chia Lee、飯田直子、前田将宏、服部奈緒子、竹島秀幸、永野玲子、小田一郎、津金昌一郎、Ming-Shiang Wu, 牛島俊和
- DOI:
- 10.1073/pnas.1717340115
研究費
国立研究開発法人日本医療研究開発機構(AMED)
革新的がん医療実用化研究事業
「高精度エピゲノム胃がんリスク診断の確立と多層的食道がんリスク診断の開発」
「ピロリ菌除菌後健康人を対象とした世界初エピゲノム発がんリスク診断の実用化」
次世代がん医療創生研究事業
「がん微小環境エピゲノム撹乱により異常産生される分泌因子を標的とした治療開発
国立がん研究センター開発費
「エピジェネティクスを標的とした予防・診断・治療法開発基盤の構築」
お問い合わせ先
報道関係からのお問い合せ先
国立研究開発法人国立がん研究センター
研究所 エピゲノム解析分野長 牛島俊和
〒104-0045 東京都中央区築地5-1-1
TEL:03-3542-2511(代表)
E-mail:tushijim"AT"ncc.go.jp
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
〒104-0045 東京都中央区築地5-1-1
TEL:03-3542-2511(代表)
E-mail:ncc-admin"AT"ncc.go.jp
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 がん研究課
〒100-0004 東京都千代田区大手町一丁目7番1号
TEL:03-6870-2221
E-mail:cancer"AT"amed.go.jp
※E-mailは上記アドレス"AT"の部分を@に変えてください。
関連リンク
掲載日 平成30年1月23日
最終更新日 平成30年1月23日


