プレスリリース 血管の防御機構を解明―腫瘍に対する新たな治療法の開発につながる研究成果―
プレスリリース
大阪大学
日本医療研究開発機構
研究成果のポイント
- 血管内皮細胞(※1)には、炎症性サイトカイン(※2)が引き起こす細胞死から血管を守る「血管の防御機構」が存在することを明らかにした。
- この防御機構は、腸内細菌によって生産誘導される炎症性サイトカインから腸と肝臓の血管を守る機構でもあった。
- さらにこの機構は、肺炎や筋炎などの炎症が生じた際に、血管を壊さずに正常に炎症反応を引き起こす仕組みであることを解明した。
- 腫瘍の増大には、栄養を届ける血管が必要なので、今回解明した血管の防御機構を阻害して、腫瘍血管を破壊することで、新たながんの治療法の開発につながる可能性がある。
- 全身の臓器を支えるこの血管の防御機構の解明は、将来的に老化による臓器機能低下の予防や、臓器の恒常性維持と修復機構の解明に結び付くことが期待できる。
概要
大阪大学微生物病研究所の内藤 尚道(ないとう ひさみち)助教、高倉 伸幸(たかくら のぶゆき)教授らの研究グループは、血管の内腔を覆う血管内皮細胞が、腸内細菌や炎症によって分泌が誘導される炎症性サイトカインから自分自身を守り、「細胞死」を防ぐ仕組みを明らかにしました。
これまで、血管内皮細胞に自分自身を積極的に守る仕組みが存在することは知られていませんでした。
本研究成果により、血管を正常に保つための仕組みの一端が明らかになるとともに、血管を壊すことが治療に結び付くがんなどに対しては、新たな治療法の開発につながることが期待されます。
本研究成果は、2019年1月10日(木)午前11時(米国東部時間)〔1月11日(金)午前1時(日本時間)〕に米国科学誌「Developmental Cell」(オンライン)に掲載されます。
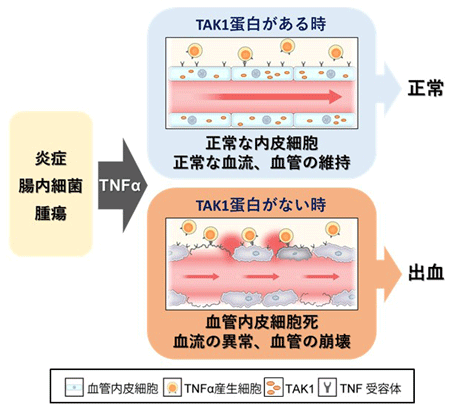
TAK1蛋白による血管内皮細胞の維持機構
研究の背景
全身に張り巡らされている血管は、酸素や栄養分を体の隅々に届けるだけでなく、組織に損傷や炎症などの異常が生じた際には、その部位に炎症細胞(※3)を動員することにより、組織の修復を促進します。この過程で、血管の内腔を覆う血管内皮細胞は、炎症性サイトカインの一つであるTNFα(※4)により活性化し、炎症細胞の血管外への遊走を助け、正常に炎症反応を惹起する役割を担っています。一方、このTNFαは多彩な機能を持つ因子として知られており、細胞の種類によっては、「細胞死」を誘導することが報告されています。しかし、血管内皮細胞がどのようにしてTNFαが誘導する「細胞死」から逃れているのかについては全く分かっていませんでした。本研究では、全身の血管内皮細胞で高発現しているタンパク質の一つであるにも関わらず、血管内皮細胞での機能がよく分かっていなかったTAK1(※5)という分子に着目して、血管内皮細胞が如何にして「細胞死」を逃れ、血管の機能を保っているかという謎の解明を目指して研究に取り組んできました。
本研究の内容
TAK1は、これまでに胎生期に血管が正常に発達するために重要であることが知られていましたが、成体の血管における機能は不明でした。そこで成体の血管、特に血管の内腔を覆う血管内皮細胞におけるTAK1の機能解析を行うため、全身の血管内皮細胞でタモキシフェンという薬剤を投与したときにのみTAK1遺伝子を欠損させることができるモデルマウス(以降このモデルマウスをTAK1ECKOマウスと呼ぶ)を作製して解析を行いました。
TAK1ECKOマウスにタモキシフェンを投与し血管内皮細胞のTAK1遺伝子を欠損させると、驚くことに薬剤投与後わずか11日で、すべてのマウスが著明な貧血を伴い死亡することが分かりました。このマウスの全身の血管を調べた結果、腸と肝臓の血管が崩壊し、出血を起こすことが死因であることが分かりました(図1)。成体の血管内皮細胞のたった1つの遺伝子を欠損するだけで、急激に個体の死を引き起こすという現象は、これまでほとんど知られていませんでした。詳細にそのメカニズムを調べると、血管内皮細胞がアポトーシスという細胞死を起こすことにより、血管の構造が崩壊して出血することが分かりました。
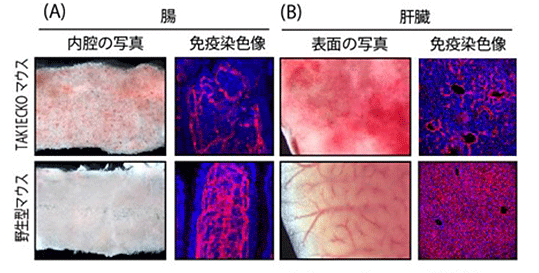
図1 TAK1ECKOマウスの腸と肝臓の写真と顕微鏡像
(A)
TAK1ECKOマウスでは腸の内腔の粘膜に出血を認める。顕微鏡で腸粘膜の血管内皮細胞(赤色)を観察すると、TAK1ECKOマウスでは血管が壊れている様子が観察できる。
(B)
野生型マウスでみられる血管が、TAK1ECKOマウスでは崩壊していて出血を認める。顕微鏡で観察すると、腸と同様に血管が崩壊している様子が観察できる。
では、なぜ全身の血管内皮細胞でTAK1を欠損させているにも関わらず、腸と肝臓の血管だけが崩壊するのか原因を調べました。その結果、この2つの部位の血管内皮細胞の細胞死には、腸内細菌が関与しているとの結果が得られました。腸では、常在する腸内細菌が免疫細胞を刺激して、炎症性サイトカインTNFαの分泌を促しています。血管内皮細胞のTAK1がないと、このTNFαにより腸の血管内皮細胞は細胞死を起こし、血管が崩壊して出血することが分かりました(図2と概要の図)。肝臓の血管内皮細胞も同様に、腸内細菌によって肝臓の免疫細胞が活性化し、TNFαが分泌されることで細胞死が生じていました。これは見方を変えると、腸内細菌から腸と肝臓の血管を守る仕組みであり、腸内細菌と共生するために必要なメカニズムだと考えられます。

図2 腸内細菌が腸の出血に関与している事を示す写真
腸と肝臓以外の部位では、血管内皮細胞のTAK1がなくても通常は異常を認めませんでしたが、肺炎や筋炎などで炎症が生じてTNFαが分泌されると、腸や肝臓と同様に、血管の崩壊と出血が起こりました(図3)。血管内皮細胞のTAK1は炎症が生じた際、血管を壊さずに正常に炎症反応を引き起こさせ、血管を守るために必要であることが分かります。
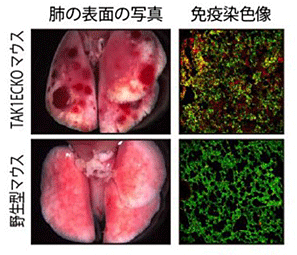
図3 肺で炎症が生じた時のTAK1ECKOマウスの肺の写真と免疫染色像
本研究結果を応用すると腫瘍の治療につながることが期待できます。腫瘍の増大には、栄養を届ける血管が必要で、腫瘍の増大とともに新しく腫瘍血管が形成されます。腫瘍血管内皮細胞のTAK1を阻害すると、腫瘍血管内皮細胞は細胞死を起こし、腫瘍血管も崩壊します。腫瘍血管が壊れると腫瘍細胞に栄養が届かなくなり腫瘍細胞も死ぬため、この「血管の防御機構」を標的とすることで、腫瘍に対する新たな血管阻害療法の開発につながることが期待されます(図4)。
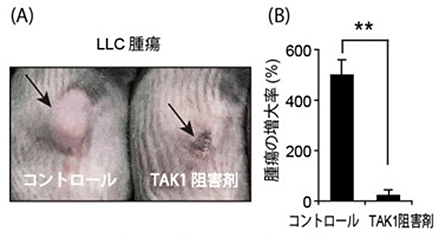
図4 TAK1阻害剤を用いて腫瘍を治療した時の写真と腫瘍の増大率
(A)
LLC腫瘍というマウスの腫瘍をTAK1阻害剤で治療した後の写真。腫瘍が縮小して、黒く壊死している様子を認める。
(腫瘍を矢印で示す)
(B)
TAK1阻害剤で治療する前後の腫瘍の大きさの変化を示すグラフ。TAK1阻害剤で治療をすると腫瘍の縮小を認める。
本研究の結果により、血管を防御する機構が初めて明らかになりました。この機構は腸内細菌とヒトが共生するために必須のメカニズムであり、怪我や感染症などで炎症が生じた際に、正常に炎症反応を引き起こさせるために必要な仕組みでもあります。今後、老化や生活習慣病における血管障害のメカニズムの解明にもつながることが期待されます。また、がんに対する新たな治療標的となることも期待されます。
本研究成果と意義
- 本研究成果により、血管内皮細胞においてTAK1がTNFαにより引き起こされる細胞死を阻止し、細胞を守っていることが明らかになりました。このように、血管が自分自身を保つための維持機構が存在することはこれまで知られていませんでした。全身の臓器は血管により支えられているので、臓器の恒常性維持と修復を理解する上でも重要なメカニズムであると考えられます。
- さらにTAK1は、腸内細菌が誘導するTNFαの刺激からも腸と肝臓の血管を守っていることがわかりました。これは腸内細菌から腸と肝臓の血管を守る仕組みであり、腸内細菌と共生するために必要なメカニズムだと考えられます。
- 老化に伴って全身で軽度な炎症反応や、腸内細菌の異常、そして血管と血管内皮細胞の障害が生じることが知られています。今後老化によるこれらの変化の分子メカニズムの解明に向けた研究に対しても貢献できることが期待されます。
- 特に腫瘍では、この「血管の防御機構」を阻害することで腫瘍血管を破壊し、腫瘍への血流を遮断して腫瘍の増大を抑制することができます。今後「血管の防御機構」を標的とした新たながん治療の開発につながる事が期待できます。
用語説明
- ※1 血管内皮細胞
- 全身の血管の内腔を覆う扁平で薄い細胞。血液と周囲の組織との間での細胞移動や、栄養素や老廃物、酸素や二酸化炭素などの物質交換を担っている。加齢や糖尿病、高血圧などが原因で機能低下をきたし動脈硬化を引き起こす。
- ※2 炎症性サイトカイン
- 主に免疫細胞から分泌され他の細胞の機能に影響を与える細胞間の伝達物質をサイトカインという。サイトカインには多くの種類が存在し、免疫、炎症、細胞増殖、細胞死など様々な機能に関与する。その中でIL-1やIL-6、TNFα等の炎症反応を引き起こすサイトカインを炎症性サイトカインと呼ぶ。
- ※3 炎症細胞
- 炎症が起きている場所に浸潤する細胞の総称。好中球、単球、リンパ球、好酸球などの血液細胞が主体となる。
- ※4 TNFα (Tumor necrosis factor alpha)
- 腫瘍壊死因子とも呼ばれる炎症性サイトカインの一つ。腫瘍に対して出血性の壊死を誘導する因子として発見されたが、最近では炎症や免疫の誘導や細胞死の誘導など様々な機能を持つことが知られている。関節リウマチや乾癬などの疾患の発症にも深く関与する。
- ※5 TAK1(Transforming growth factor beta-activated kinase 1、別名MAP3K7)
- 細胞内情報伝達を担うタンパク質の一つ。多くの細胞で発現しており、TGFβやBMP、TNFα、IL-1など様々なサイトカインによるシグナル伝達に関与し、炎症反応や免疫反応、細胞死など生体にとって重要な現象に関与する。
掲載論文・雑誌
本研究成果は、2019年1月10日(木)午前11時(米国東部時間)〔1月11日(金)午前1時(日本時間)〕に米国科学誌「Developmental Cell」(オンライン)に掲載されます。
- 論文タイトル:
- “TAK1 Prevents Endothelial Apoptosis and Maintains Vascular Integrity”
- 「TAK1は血管内皮細胞の細胞死を防ぎ血管の恒常性を維持する」
- 著者:
- Hisamichi Naito*, Tomohiro Iba, Taku Wakabayashi, Ikue Tai-Nagara, Jun-ichi Suehiro, Weizhen Jia, Daisuke Eino, Susumu Sakimoto, Fumitaka Muramatsu, Hiroyasu Kidoya, Hiroyuki Sakurai, Takashi Satoh, Shizuo Akira, Yoshiaki Kubota, Nobuyuki Takakura*
* Corresponding authors.
特記事項
本研究は、日本医療研究開発機構(AMED)老化メカニズムの解明・制御プロジェクト「個体・臓器老化研究拠点」(研究代表者:片桐秀樹)の研究課題「血管老化の分子機構の解明とその制御(研究分担者:高倉伸幸)」、次世代がん医療創生研究事業(P-CREATE)の研究課題「腫瘍血管正常化によりがん悪性化を制御する治療法の開発(研究代表者:高倉伸幸)」、革新的先端研究開発支援事業ソロタイプ(PRIME)「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出(研究開発総括:吉村昭彦)」の研究課題「血管内皮幹細胞システムを基軸とした血管の恒常性維持と修復機構の解明(研究代表者:内藤尚道)」、文部科学省科学研究費補助金、公益財団法人武田科学振興財団医学系研究助成、大阪大学先導的学際研究機構生命医科学融合フロンティア研究部門および公益財団法人アステラス病態代謝研究会の研究支援を受け、慶応大学と杏林大学の共同研究チームによって実施されました。
本件に関する問い合わせ先
研究内容に関するお問い合わせ先
大阪大学 微生物病研究所 情報伝達分野
教授 高倉 伸幸(たかくら のぶゆき)
TEL:06-6879-8316 FAX:06-6879-8314
E-mail:ntakaku"AT"biken.osaka-u.ac.jp
ホームページ:大阪大学 微生物病研究所 情報伝達分野 高倉研
助教 内藤 尚道(ないとう ひさみち)
TEL:06-6879-8312
E-mail:naitohi"AT"biken.osaka-u.ac.jp
取材に関する問い合わせ先
大阪大学微生物病研究所企画広報推進室
中込 咲綾(なかごみ さや)
TEL:06-6879-8357 FAX:06-6879-8360
E-mail:nakagomi"AT"biken.osaka-u.ac.jp
AMED事業に関する問い合わせ先
国立研究開発法人 日本医療研究開発機構
〒100-0004 東京都千代田区大手町1-7-1
基盤研究事業部 研究企画課
TEL:03-6870-2224 FAX:03-6870-2246 E-mail:kenkyuk-ask"AT"amed.go.jp
戦略推進部 がん研究課
TEL:03-6870-2221 FAX:03-6870-2244 E-mail:cancer"AT"amed.go.jp
※E-mailは上記アドレス"AT"の部分を@に変えてください。
掲載日 平成31年1月11日
最終更新日 平成31年1月11日


