プレスリリース がんの診断・治療につながる環状ペプチドを発見!
プレスリリース
金沢大学
東京大学
理化学研究所
日本医療研究開発機構(AMED)
金沢大学がん進展制御研究所/ナノ生命科学研究所/新学術創成研究機構の酒井克也助教、柴田幹大准教授、松本邦夫教授、東京大学大学院理学系研究科の菅裕明教授、理化学研究所生命機能科学研究センターの向井英史ユニットリーダー、渡辺恭良チームリーダーらの共同研究グループは、がん細胞の転移や抗がん剤耐性を促進する肝細胞増殖因子(HGF)(※1)と特異的に結合する環状ペプチド(※2)「HiP-8」を発見し、HiP-8がHGFの作用を阻害すること、およびHiP-8により体内のHGFが豊富ながん組織を可視化できることを実証しました。
HGFは細胞外に分泌されるタンパク質であり、その受容体タンパク質METと結合することで、組織の成長・再生を促します。ところが、さまざまながん組織においては、HGFががん細胞に作用すると、がんの転移や抗がん剤に対する耐性獲得を促進します。そのため、HGF-METの結合を阻害する分子の開発が求められています。
本共同研究グループは、RaPID法(※3)を用いて、HGFに結合する環状ペプチドを初めて取得することに成功しました。この環状ペプチド「HiP-8」は、極めて高い特異性でHGFに結合するとともに、HGFの作用を阻害することを明らかにしました。また、放射性同位元素で標識したHiP-8をがんモデルマウスに投与することで、個体内のHGFが豊富ながん組織をPET(ポジトロン断層法)イメージング(※4)により可視化できることを実証しました。
これらの研究成果は、転移性の高いがんや抗がん剤が効き難いがんの治療や画像診断に活用されることが期待されます。
本研究成果は、2019年5月17日(米国東海岸標準時間)に国際科学雑誌『Nature Chemical Biology』に掲載される予定です。
研究の背景
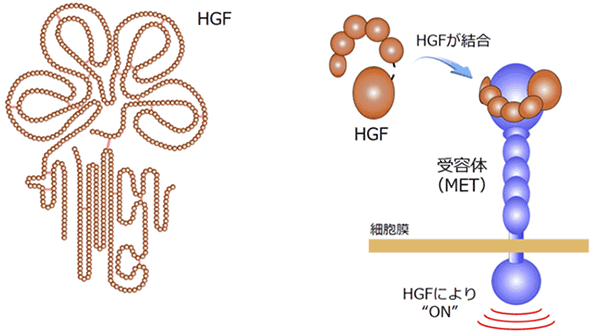
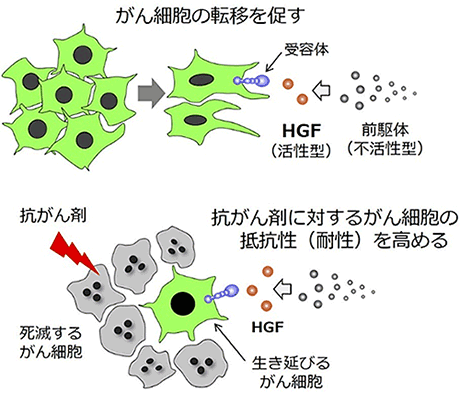
HGFは細胞増殖因子と呼ばれるタンパク質の一種であり、細胞膜上の受容体タンパク質METと結合することによってその生理作用を発揮し(図1)、細胞の増殖や遊走、組織の修復・再生を促します。がん組織においては、がん細胞の浸潤や生存を促進する結果、がんの転移や抗がん剤の効き目を弱める薬剤耐性の獲得に関与します(図2)。HGFは活性のない前駆体HGFとしてさまざまな組織に存在する一方、がん細胞近傍でのみ活性型HGFに変換されます(図2)。そのため、活性型HGFのみを選択的に阻害・検出する分子が、がんの治療用医薬や診断薬として期待されますが、これまでそのような分子は取得されていませんでした。
特定の分子を選択的に阻害する分子標的薬は、がんを含む多数の疾患に利用されています。中でも、抗体タンパク質は標的分子に高い特異性を持っていますが、コストが高いことが難点です。一方、化合物医薬は、化学合成で製造できるため安価ですが、標的分子に対する特異性は高くありません。そこで最近にわかに注目されているのが、抗体タンパク質に匹敵する標的特異性を持ち、化学合成で製造可能な環状ペプチドです。
研究成果の概要
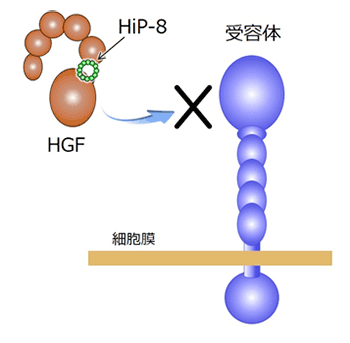
本共同研究グループは、まず、グループ内の菅裕明教授によって確立されたRaPID法を用いて、活性型HGFにのみ特異的に結合しHGFの作用を阻害する環状ペプチド「HiP-8」を世界で初めて取得することに成功しました。HiP-8は12個のアミノ酸がリング状に連結した環状ペプチドであり(図3)、極微量でHGFに結合し、HGFがその受容体METに結合することを阻害します(図3)。
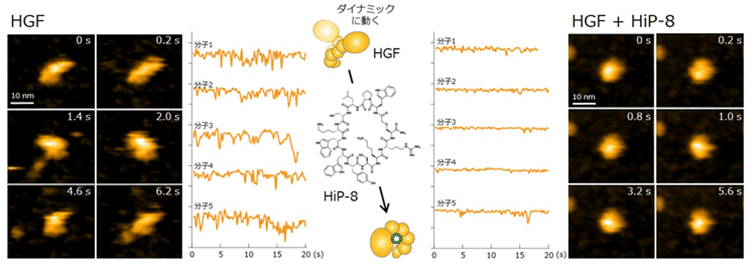
また、本研究では、HiP-8のHGFへの作用機作を明らかにするため、生体分子のリアルな動きや形状変化を観察できる高速原子間力顕微鏡(HS-AFM)(※5)を用いて、HiP-8の作用を観察しました(図4)。その結果、HGF分子の形状はダイナミックに変化しているのに対して、HiP-8が結合すると、HGF分子のダイナミックな形状変化(分子動態)が強く阻害されることを可視化することに成功しました。タンパク質の活発な分子動態が小さな分子によって阻害されることを観察した初めての成果です。
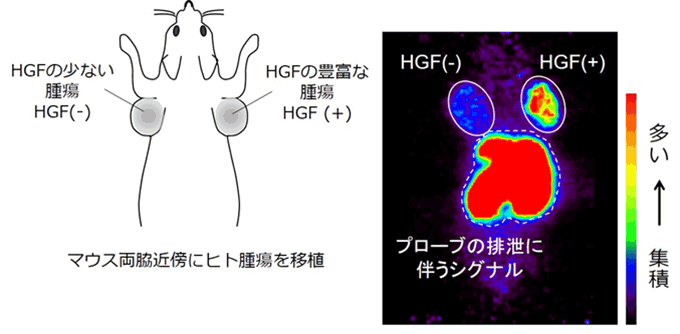
さらに、本共同研究グループは、HiP-8のがん診断への応用を検討するため、ヒト肺がん組織を移植したマウスに放射性同位元素で標識したHiP-8を投与し、PET(ポジトロン断層法)によるイメージング解析を行いました。解析の結果、HiP-8は活性型HGFの豊富ながん組織に選択的に集積することを明らかにしました(図5)。本結果は、HiP-8は画像診断のためのPETプローブとして有用であることを示唆しています。また、HiP-8はHGFの作用を阻害することから、活性型HGFに選択的な抗がん剤としての応用が期待されます。
https://pfm02.imc.kanazawa-u.ac.jp/pfm/index.php?id=20190507072343SVVVLXJO
今後の展開
本研究により、環状ペプチドHiP-8を用いた新しいPET検査法の開発や、活性型HGFだけを選択的に阻害する分子標的薬の開発につながると期待されます。
本研究は、文部科学省世界トップレベル研究拠点プログラム(WPI)、国立研究開発法人日本医療研究開発機構(AMED)次世代がん医療創生研究事業「イメージング活用創薬の視点からの異分野技術融合によるシームレスな薬効評価システムの構築と実施」(研究代表者 渡辺恭良、研究開発分担者 松本邦夫、向井英史)、AMED革新的バイオ医薬品創出基盤技術開発事業「特殊環状ペプチドを中核とした革新的次世代バイオ医薬品開発の加速」(研究代表者 菅裕明)、日本学術振興会科学研究費助成事業、国立研究開発法人科学技術振興機構(JST)、公益財団法人武田科学振興財団、公益財団法人三谷研究開発支援財団、大阪大学タンパク質研究所共同研究事業、金沢大学がん進展制御研究所共同研究費の支援を受けて実施されました。
掲載論文
- 雑誌名:
- Nature Chemical Biology
- 論文名:
- Macrocyclic peptide-based inhibition and imaging of hepatocyte growth factor
- (環状ペプチドによる肝細胞増殖因子(HGF)の阻害とイメージング)
- 著者名:
- Katsuya Sakai, Toby Passioura, Hiroki Sato, Kenichiro Ito, Hiroki Furuhashi, Masataka Umitsu, Junichi Takagi, Yukinari Kato, Hidefumi Mukai, Shota Warashina, Maki Zouda, Yasuyoshi Watanabe, Seiji Yano, Mikihiro Shibata, Hiroaki Suga*, Kunio Matsumoto*
- (酒井克也1,2、パショウラ・トビー3、佐藤拓輝2、伊藤健一郎3、古橋弘貴2、海津正賢4、高木淳一4、加藤幸成5、向井英史6、藁科翔太6、造田真希6、渡辺恭良6、矢野聖二1,2、柴田幹大2,7、菅裕明3*、松本邦夫1,2,7*)(*責任著者)
-
- 金沢大学がん進展制御研究所
- 金沢大学ナノ生命科学研究所
- 東京大学大学院理学系研究科
- 大阪大学蛋白質研究所
- 東北大学大学院医学系研究科・未来科学技術共同研究センター
- 理化学研究所生命機能科学研究センター
- 金沢大学新学術創成研究機構
- 掲載日:
- 2019年5月17日(米国東海岸標準時間)にオンライン版に掲載
- DOI:
- 10.1038/s41589-019-0285-7
用語解説
- ※1 肝細胞増殖因子(HGF)
- Hepatocyte Growth Factor(肝細胞増殖因子)の略称。日本で発見された増殖因子で、肝臓や腎臓の再生や神経の保護を担う生理活性タンパク質。HGFは細胞の増殖促進作用に加え、細胞の遊走や生存を促す作用が強く、がん組織でHGFの過剰な産生が起こると、がんの転移や抗がん剤に対する耐性につながる。
- ※2 環状ペプチド
- アミノ酸が数個から数十個つながった鎖状の物質はペプチドと呼ばれる。環状ペプチドは、ペプチド鎖の中の2つのアミノ酸同士が結合し、その結果、リング状(環状)の構造を持つものをいう。最近、環状ペプチド構造を持つ医薬品候補が世界的に注目されている。
- ※3 RaPID法
- Random Peptide Integrated Discoveryの略。東京大学大学院理学系研究科の菅裕明教授によって確立された手法で、標的となる生体分子(主にタンパク質)に高い特異性と親和性で結合できる環状ペプチドを高効率かつ敏速にスクリーニング・取得する手法。人工的なtRNA合成系(フレキシザイム)と翻訳合成系を組み合わせ、天然のアミノ酸(20種類)に加えて、非天然アミノ酸もペプチド合成に使うことにより、自発的に環状構造を持つ膨大な構造多様性のある環状ペプチドが合成され、その中から標的分子に結合する環状ペプチドを高い効率で取得できる。
- ※4 PET(ポジトロン断層法)イメージング
- Positron Emission Tomographyの略。陽電子を放出する放射性同位元素(陽電子放出核種)で化合物やタンパク質等を標識し、生体内でのそれらの分布を画像化する手法。陽電子放出核種で標識した化合物をPETプローブと呼び、微量のPETプローブを体内に注入することで、その集積を非侵襲的に3次元画像化し定量する。同一個体での経時観察やヒトの機能画像取得に特に威力を発揮し、薬剤などをPETプローブ化することで薬剤の臓器への分布などを調べたり、疾患部位に集積するPETプローブを用いて画像診断を行うことができる。
- ※5 高速原子間力顕微鏡(HS-AFM)
- 金沢大学で世界に先駆けて実用化された顕微鏡。柔らかい板バネの先に付いた針の先端で試料に触れ、針と試料の水平方向の相対位置を変えながら試料表面の高さを計測することにより、試料の表面形状や動きを可視化することができる。
お問い合わせ先
研究内容に関すること
金沢大学 ナノ生命科学研究所/がん進展制御研究所/新学術創成研究機構
教授 松本 邦夫(まつもと くにお)
TEL:076-264-6745
E-mail:kmatsu"AT"staff.kanazawa-u.ac.jp
東京大学大学院 理学系研究科
菅 裕明(すが ひろあき)
TEL:03-5841-8372
E-mail:hsuga"AT"chem.s.u-tokyo.ac.jp
理化学研究所 生命機能科学研究センター
向井 英史(むかい ひでふみ)
TEL:078-304-7173
E-mail:hmukai"AT"riken.jp
広報担当
金沢大学 総務部 広報室広報係
嘉信 由紀(かしん ゆき)
TEL:076-264-5024
E-mail:koho"AT"adm.kanazawa-u.ac.jp
金沢大学 ナノ生命科学 研究所事務室
米田 洋恵(よねだ ひろえ)
TEL:076-234-4556
E-mail:nanolsi-office"AT"adm.kanazawa-u.ac.jp
東京大学大学院 理学系研究科・理学部 広報室
武田 加奈子(たけだ かなこ)
TEL:03-5841-0654
E-mail:kouhou.s"AT"gs.mail.u-tokyo.ac.jp
理化学研究所 生命機能科学研究センター センター長室
山岸 敦(やまぎし あつし)
TEL:078-306-3095
E-mail:ayamagishi"AT"riken.jp
理化学研究所 広報室 報道担当
TEL:048-467-9272
E-mail:ex-press"AT"riken.jp
AMED事業に関するお問い合わせ先
国立研究開発法人 日本医療研究開発機構(AMED)
戦略推進部 がん研究課
TEL:03-6870-2221
E-mail:cancer"AT"amed.go.jp
創薬戦略部 医薬品研究課
TEL:03-6870-2219
E-mail:kaku-bio27"AT"amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和元年5月18日
最終更新日 令和元年5月18日


