プレスリリース 皮膚バリアの形成に重要な脂質の産生機構を解明―皮膚バリア関連疾患の治療薬の開発に期待―
プレスリリース
北海道大学
日本医療研究開発機構
ポイント
- 皮膚バリア形成に働くセラミドの中でも最も重要なアシルセラミド産生に働く遺伝子を同定。
- アシルセラミドの産生経路を解明。
- 魚鱗癬未熟児症候群における皮膚症状の発症原因を解明。
概要
北海道大学大学院薬学研究院の木原章雄教授らの研究グループは、皮膚における透過性バリア(皮膚バリア)の形成において最も重要な脂質であるアシルセラミドの産生過程で不明であったアシルCoA*1合成酵素遺伝子(FATP4)の同定に成功しました。本研究成果により、同研究グループがこれまで提唱してきたアシルセラミドの生合成経路の妥当性が確かめられ、アシルセラミドの産生経路の解明につながりました。FATP4遺伝子の変異は、難病である魚鱗癬(ぎょりんせん)未熟児症候群を引き起こすことが知られています。本研究成果により、この疾患の皮膚症状(魚鱗癬)の発症原因がアシルセラミドの産生異常であることが明らかになっただけでなく、皮膚バリア異常に起因する皮膚疾患の治療薬の開発につながると期待されます。
なお、本研究は国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「画期的医薬品等の創出をめざす脂質の生理活性と機能の解明」研究開発領域(研究開発総括:横山信治)における研究開発課題「脂質による体表面バリア形成の分子機構の解明」(研究開発代表者:木原章雄)の一環として行われました。
また、本研究成果は、日本時間2020年1月21日(火)午前5時(アメリカ東部時間2020年1月20日(月)午後3時)公開のProceedings of the National Academy of Sciences of the United States of America誌(米国科学アカデミー紀要)に掲載されます。
背景
人間の体の最も外側に位置する皮膚には物質の透過を防ぐ強力なバリアが存在します。この皮膚バリアは病原体、アレルゲン、有害物質の侵入を阻止し、体内からの水分の蒸発も防いでいます。通常、人間は皮膚バリアのおかげで皮膚を介して病原菌等に感染することはほとんどありませんが、火傷や怪我などで皮膚バリアが壊されると、感染のリスクが著しく増加します。
遺伝子異常によって皮膚バリアの形成が損なわれた疾患として、先天性魚鱗癬があります。この疾患では、皮膚の形態が魚の鱗(うろこ)のように変化することからこのような名前がつけられました。アトピー性皮膚炎患者でも魚鱗癬ほどではありませんが、皮膚バリア機能が低下しており、アレルゲンが侵入しやすくなっています。
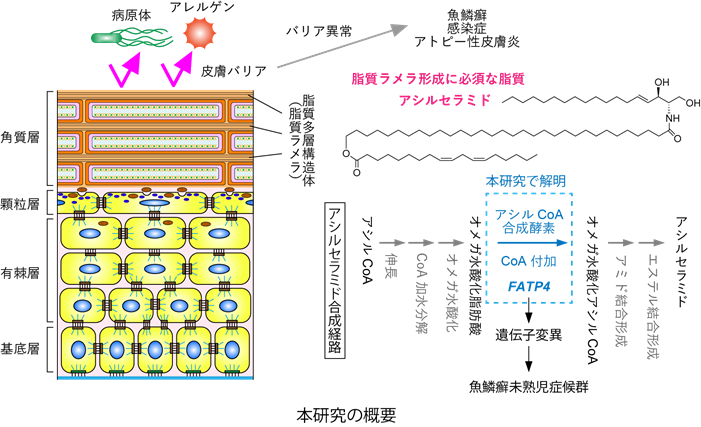
脂質とは、生体に存在する水に溶けない有機化合物の総称であり、多くの種類があります。脂質と聞くと油や脂肪というエネルギー源としてのイメージしか持たない人が多いかもしれませんが、脂質にはさまざまな機能があり、水に溶けない性質を活かした透過性バリアとしての役割も重要です。最近、特に化粧品のコマーシャルでセラミドという言葉を聞くことが増えてきましたが、セラミドは脂質の一種です。セラミドは全身に存在しますが、特に皮膚の最も外側の角質層(角層)に多量に存在し、皮膚バリア形成に極めて重要な働きを担っています。セラミドにもさまざまな種類があり、その中でもアシルセラミドは皮膚バリア形成に特化した”バリア脂質”であり、皮膚バリア形成に必須です。
皮膚は外側から表皮、真皮、皮下組織に分かれます。また、表皮はさらに4層(外側から角質層、顆粒層、有棘層、基底層)に分けられ、最も外側の角質層に脂質の多層構造体(脂質ラメラ)が存在し、角質層に存在する細胞の間を埋めています。この脂質ラメラこそが、皮膚バリア機能に最も重要な構造体であり、この多層構造体を形成するためにはアシルセラミドが必要とされています。
通常のセラミドが2本の炭化水素鎖構造(1本の長鎖塩基*2と1本の脂肪酸*3)を持っているのに対して、アシルセラミドは3本の炭化水素鎖(1本の長鎖塩基と2本の脂肪酸)からなる複雑な構造を持ちます。生体にはタンパク質、核酸、糖、脂質などの様々な分子(生体分子)が存在しますが、それらはいずれも酵素が触媒する化学反応の連続によって作られます。また、タンパク質である酵素は遺伝子によってコードされており、通常のセラミドを産生する酵素及びそれらをコードする遺伝子についてはすでに明らかにされていました。一方、アシルセラミドは複雑な構造を持つため、その産生のためには通常のセラミドよりも多くの化学反応とそれを触媒する酵素が必要ですが、それらは長い間不明でした。
研究グループは、最近アシルセラミド合成に関わる多くの酵素の遺伝子を明らかにし、アシルセラミド合成の産生経路と産生に関わる反応を予測しました。その中で、まだ不明な酵素として残っていたのが、本研究において解明したアシルCoA合成酵素(脂肪酸にCoAを付加する反応を触媒)でした。ヒトには26種類のアシルCoA合成酵素が存在します。その中の一つが本研究によってアシルセラミド合成に関わることが明らかになったFATP4です。FATP4遺伝子が変異すると魚鱗癬未熟児症候群(未熟児として出生し、呼吸困難、皮膚での魚鱗癬を伴う)という遺伝病が引き起こされます。FATPの名前はFatty acid transporter(脂肪酸輸送体)に由来しており、元々は脂肪酸を細胞に輸送する機能があると推定されていました。そのため、これまでは魚鱗癬未熟児症候群の発症のメカニズムとして皮膚への脂肪酸取り込みが低下することが原因という仮説が有力でした。
しかし、研究グループはこれまでとは全く異なった新たな仮説(FATPがアシルセラミド合成に直接関与する)を打ち立て、本研究において証明しました。
研究手法
研究グループは、マウスのFATP4タンパク質をコードする遺伝子(Fatp4)が欠損(ノックアウト;KO)したマウス(Fatp4 KOマウス)を作成しました。このマウスの皮膚バリア機能については、皮膚からの水分蒸散量(経皮水分蒸散量)と色素の浸透(トルイジンブルー染色)によって評価し、皮膚の形態はヘマトキシリン/エオジンという色素で染色後、顕微鏡観察により行いました。詳細な皮膚の形態については、透過型電子顕微鏡で観察を行い、アシルセラミドを含む脂質の定量は液体クロマトグラフィー連結型タンデム質量分析によって行いました。また、ヒトの角化細胞のFATP4遺伝子の発現低下(ノックダウン)はRNA干渉*4によって行い、アシルCoA合成酵素の活性の測定は、細胞にFATP4を過剰発現させた膜画分を用いて行いました。
研究成果
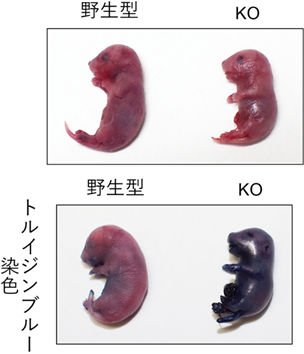
Fatp4 KOマウスは生後すぐに死亡しました。Fatp4 KOマウスの皮膚は、野生型マウスに比べてしわが少なく張っており(図1上)、Fatp4 KOマウスの皮膚を介した体内からの水分蒸散量は、野生型マウスの約4.4倍増加していました。トルイジンブルー染色により体外から体内への皮膚透過性バリア機能を調べたところ、野生型マウスでは色素の浸透は見られなかったのに対し、Fatp4 KOマウスでは強い浸透が見られました(図1下)。これらの結果は、Fatp4 KOマウスの皮膚バリア機能に異常があることを示しています。
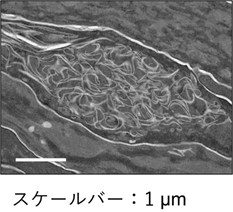
次に、Fatp4 KOマウスの表皮の形態異常の有無を調べるため、ヘマトキシリン/エオジン染色を行ったところ、野生型マウスの角質層では脂質ラメラの存在を示す角質細胞間の間隙が観察され、10層未満の角質層が存在していました。一方、Fatp4 KOマウスでは角質層の数の増加が観察され、脂質ラメラの存在を示す角質細胞間の間隙は不明瞭でした。また、透過型電子顕微鏡での観察により表皮の微細構造を解析したところ、Fatp4 KOマウスの角質層上部には魚鱗癬未熟児症候群患者にも見られる空胞や異常な繊維状の膜構造体が観察されました(図2)。これらの結果は、Fatp4 KOマウスでは脂質ラメラ形成を含む角質層の形成に異常があることを示しています。
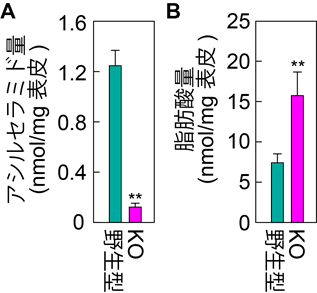
更に、Fatp4遺伝子欠損がアシルセラミド産生に与える影響を調べるために、表皮中のアシルセラミド量を質量分析によって調べました。その結果、Fatp4 KOマウス中でのアシルセラミド量は野生型マウスの約9.8%にまで低下していました(図3A)。一方、Fatp4 KOマウスの表皮における脂肪酸量は野生型マウスと比較して減少しておらず、むしろ増加していました(図3B)。このことは、これまで提唱されていた脂肪酸取り込みの低下が魚鱗癬発症のメカニズムであるという仮説を否定しました。次に、Fatp4 KOマウスで観察されたアシルセラミドの減少がヒトの角化細胞(表皮を構成する主要な細胞)でも見られるのかを調べたところ、ヒトの角化細胞中でFATP4遺伝子をノックダウン(ノックダウン効率90%以上)させるとアシルセラミド量が約40%減少しました。
アシルセラミド産生経路においては、オメガ位(カルボン酸側とは逆の炭素末端)が水酸化された脂肪酸がアシルCoA合成酵素の基質となります。そこで、FATP4が実際にこのような脂肪酸をアシルCoAへ変換させる活性を持つかどうかを調べるため、酵素活性測定を行いました。酵素活性測定にはFATP4を過剰発現させた細胞から調製した生体膜成分(膜画分)を用い、その比較対象(コントロール)としてはFATP4を過剰発現させていない膜画分を使用しました。その結果、FATP4を過剰発現させた膜画分はコントロールに比べ、10.5倍量のアシルCoA産生活性を示しました。
以上の結果から、FATP4がアシルセラミド産生経路において働くアシルCoA合成酵素であることが明らかとなり、アシルセラミド合成経路中にオメガ水酸化脂肪酸をオメガ水酸化アシルCoAへ変換する反応が存在するという、本研究グループが予測したアシルセラミド産生経路の妥当性も示されました。
今後への期待
本研究では、皮膚バリア形成に最も重要な脂質であるアシルセラミドの産生経路を解明し、皮膚におけるバリア形成の分子機構の解明に大きく寄与しました。難病である魚鱗癬には有効な治療薬が存在しません。また、アトピー性皮膚炎も対症療法*5に頼っているのが現状です。これらの疾患はいずれも皮膚バリアの異常が原因になっているので、その異常を元に戻せるような治療薬(例えば、アシルセラミドあるいは類似化合物の皮膚への塗布、生体内のアシルセラミド産生を増やすような薬)が開発されれば、有効な魚鱗癬治療薬やアトピー性皮膚炎の原因療法が可能になると期待されます。
論文情報
- 論文名
- Skin permeability barrier formation by the ichthyosis-causative gene FATP4 through formation of the barrier lipid ω-O-acylceramide
- (魚鱗癬原因遺伝子FATP4によるバリア 脂質アシルセラミド産生を介した皮膚透過性バリア形成)
- 著者名
- 山本春佳1、服部未来1、Walee Chamulitrat2、大野祐介1、木原章雄1
- (1北海道大学大学院薬学研究院、2ハイデルベルグ大学病院)
- 雑誌名
- Proceedings of the National Academy of Sciences of the United States of America(米国科学アカデミー紀要)
用語解説
- *1 アシルCoA
- 脂肪酸が活性化(合成や分解がされやすい状態になること)し、脂肪酸に補酵素A
(コエンザイムA;CoA)が結合した状態の分子。 - *2 長鎖塩基
- 長鎖塩基アミノ基(-NH2)を持つ炭化水素鎖で、セラミドの構成成分。
- *3 脂肪酸
- カルボキシ基(-COOH)を持つ炭化水素鎖のこと。炭素数16から20の脂肪酸は脂質
の主要な構成成分。 - *4 RNA干渉
- 低分子二本鎖RNAを利用して目的遺伝子のmRNAを破壊し、遺伝子発現を抑制する
現象。 - *5 対症療法
- 疾患の原因を治すのではなく、症状を軽減するための治療法のこと。
お問い合わせ先
北海道大学大学院薬学研究院
教授 木原章雄(きはらあきお)
TEL:011-706-3754 FAX:011-706-4900
メール:kihara”AT”pharm.hokudai.ac.jp
北海道大学 大学院薬学研究院 生化学研究室ウェブサイト
配信元
北海道大学総務企画部広報課
(〒060-0808 札幌市北区北8条西5丁目)
TEL:011-706-2610 FAX:011-706-2092
メール:kouhou”AT”jimu.hokudai.ac.jp
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部研究企画課
(〒100-0004 東京都千代田区大手町1-7-1 読売新聞ビル)
TEL:03-6870-2224
メール:kenkyuk-ask”AT”amed.go.jp
※メールは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和2年1月21日
最終更新日 令和2年1月21日


