プレスリリース 心筋細胞は柔らかい足場で効率よく誘導される―新しい心臓再生法の確立に向けて―
プレスリリース
国立大学法人筑波大学
国立研究開発法人日本医療研究開発機構
研究成果のポイント
- 心臓再生法の一つとして、ウイルスベクターを使って、心臓線維芽細胞から心筋細胞を誘導(心筋誘導)する際、その足場となる細胞外基質(注1)の柔らかさが、心筋誘導効率を左右することを発見しました。
- 生体の心臓と同等の柔らかさを持つ細胞外基質上で心筋の誘導が促進されるメカニズムを明らかにしました。
- 柔らかい細胞外基質上では、用いるウイルスベクターの種類にかかわらず心筋誘導の効率が改善することから、さまざまな心疾患に対する新しい心臓再生法への応用が期待できます。
概要
国立大学法人筑波大学医学医療系循環器内科家田真樹教授、貞廣威太郎講師らの研究グループは、心臓の柔らかさを再現した足場を用いると、マウス線維芽細胞から心筋細胞への誘導が促進されることを発見しました。
本研究グループはこれまでに、新しい心臓再生法として、心臓に存在する心筋以外の心臓線維芽細胞に心筋誘導遺伝子(注2)を導入し、培養皿上やマウス生体内で心筋細胞を作製できることなどを報告してきましたが、臨床応用にあたっては、成熟した心筋細胞を効率よく誘導する必要がありました。これまでに、生体外で誘導した心筋細胞よりも、生体心臓内で誘導した心筋細胞の方が成熟した性質を有しており、細胞周囲の環境が心筋誘導に影響することが示唆されていましたが、そのメカニズムは不明でした。また、従来の細胞培養で使用するプラスチック(ポリスチレン)製の培養皿は生体心臓に比べて約10万倍硬いことが知られていますが、細胞外基質の硬さが心筋誘導に与える影響は未解明でした。
本研究では、生体心臓と同等の柔らかさの細胞外基質を敷いた培養皿を使用すると、心筋誘導効率が飛躍的に上昇し、成熟した心筋細胞を効率よく誘導できることを発見しました。生体心臓より硬い培養皿上では、細胞内のインテグリン(注3)、Rho/ROCK(注4)、ミオシン(注5)、YAP/TAZ(注6)シグナル経路と線維化遺伝子の発現が進み、心筋細胞への誘導が阻害されていることがわかりました。一方、生体心臓と同等の柔らかい細胞外基質を敷いた培養皿では、このシグナル経路と線維化遺伝子発現が抑制され、心筋誘導が改善しました。さらに、柔らかい細胞外基質の使用により、現在最も効率が良いセンダイウイルスベクター(注7)による心筋誘導も2倍に改善し、拍動する成熟した心筋細胞の誘導効率が15%まで上昇しました。
本研究成果は、心筋誘導のメカニズム解明に貢献するだけでなく、心筋梗塞や拡張型心筋症など、心臓が硬い線維化組織に置換されるさまざまな心臓疾患への再生医療の応用が期待されます。
本研究の成果は、2020年8月27日付「Stem Cell Reports」でオンライン先行公開される予定です。
*本研究は国立研究開発法人日本医療研究開発機構(AMED)の再生医療実現拠点ネットワークプログラム「幹細胞・再生医学イノベーション創出プログラム」および革新的先端研究開発支援事業(ソロタイプ)「メカノバイオロジー機構の解明による革新的医療機器及び医療技術の創出」、公益財団法人武田科学振興財団、公益財団法人先進医薬研究振興財団、公益財団法人かなえ医薬振興財団、公益財団法人上原記念生命科学財団、公益財団法人持田記念医学薬学振興財団、公益財団法人車両競技公益資金記念財団、JSPS科研費17J06637、18K08114、18K08047、19K22613の支援によって行われました。
研究の背景
心疾患では心筋細胞が壊死し、心臓壊死組織は線維芽細胞の増殖と線維化により置換され、最終的に心不全に至ります。これに対してiPS細胞を用いた心筋再生が期待されていますが、腫瘍形成の可能性、移植心筋細胞の未熟性や低い組織生着率などの課題があります。これらを解決するために、本研究グループはこれまでに、心臓線維芽細胞に心筋誘導遺伝子を導入して、iPS細胞を介さずに直接的に心筋細胞を誘導する新たな方法を開発し、さらにマウス生体内において心筋梗塞部位での心筋誘導に成功してきました(参考文献1、2、3、4)。しかしながら、臨床応用へ向けては、成熟した心筋細胞の誘導効率を改善する必要があります。これまでの研究から、生体外で誘導した心筋細胞よりも、生体心臓内で誘導した心筋細胞の方が、心筋として成熟した性質を有しており、生体内環境が心筋誘導効率を改善することは示唆されていましたが、そのメカニズムは不明でした(参考文献5、6、7、8)。
生体組織の硬さは、健常な心臓が10kPa(注8)程度であるのに対して、脳は約1kPa、骨は100kPa程度と臓器により大きく異なります。また、心筋梗塞後など病的な心臓の線維化組織は骨と同等の100kPa程度まで硬くなることが知られています。これに対して通常のポリスチレン製の培養皿は、心臓と比べて約10万倍の硬さ(1GPa)があります。このように細胞の足場となる細胞外基質の硬さは、生体組織と通常の培養皿で大きく異なりますが、これまで細胞外基質の硬さ(機械的刺激)が心筋誘導に与える影響は未解明でした。
研究内容と成果
1.細胞外基質の硬さと心筋誘導の関連
そこで本研究では、ハイドロゲル(注9)を用いて、1kPaから126kPaまで様々な生体組織の硬さを模倣した細胞培養システムを構築し、細胞の足場(細胞外基質)の硬さと線維芽細胞から心筋細胞への誘導効率の関係を解析しました(図1A)。その結果、心臓の硬さと同等の細胞外基質を用いることで(8kPa)、最も高い心筋誘導が確認されました。これに対して、1kPaの細胞外基質上では、細胞が培養皿からはがれ死滅しました。また骨と同等の硬さの細胞外基質(126kPa)やポリスチレン製の培養皿上では、拍動する機能的に成熟した心筋細胞の誘導効率が、8kPaの細胞外基質上と比較して1/2から1/3程度まで低下することがわかりました(図1B)。
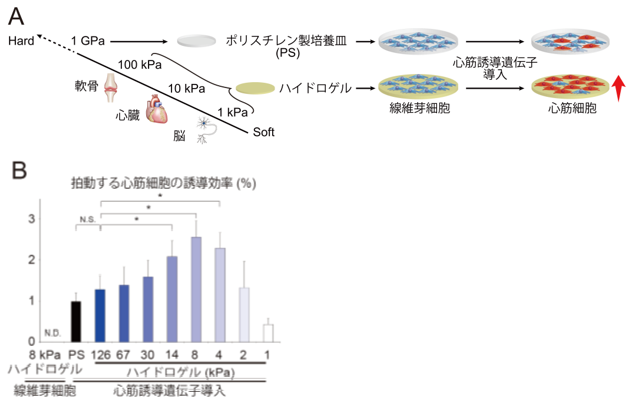
B:細胞外基質の硬さによる心筋細胞誘導効率の変化を示す。心臓と同等の柔らかさの8kPaのハイドロゲルで最も心筋誘導効率が改善した。
2.柔らかい細胞外基質上で心筋誘導が促進される分子メカニズム
次に、細胞外基質の硬さにより心筋誘導が変化する分子メカニズムを解析しました。まず同種類のハイドロゲルを用いて作成した8kPaと126kPaの細胞外基質上で、心筋誘導遺伝子(Gata4、Mef2c、Tbx5、Hand2)の導入による線維芽細胞から心筋誘導を行い、遺伝子発現変化を網羅的に解析しました。その結果、心臓と同等の柔らかさの8kPaの細胞外基質では、足場からの機械的刺激を細胞内に伝達するインテグリンシグナル、その下流の転写調節因子であるYAPおよびTAZ遺伝子、線維化関連遺伝子の発現が抑制されており、それに伴い心筋誘導が上昇していました。一方、骨と同等の硬さの126kPaの細胞外基質では、機械的刺激を伝達するインテグリン、Rho/ROCK、ミオシン、YAP/TAZ遺伝子、さらに線維化遺伝子の発現が上昇しており、心筋誘導が低下していました。またポリスチレン製の培養皿では、126kPaの細胞外基質と同様に、インテグリン、YAP/TAZ遺伝子や線維化関連遺伝子の発現が上昇しており、心筋誘導が低下していました。これに対して、126kPaの細胞外基質やポリスチレン製の培養皿上で活性化するインテグリン、Rho/ROCK、ミオシンを直接阻害する薬剤や、YAPおよびTAZ遺伝子の発現を抑制することで、心筋誘導効率が改善することがわかりました(図2)。
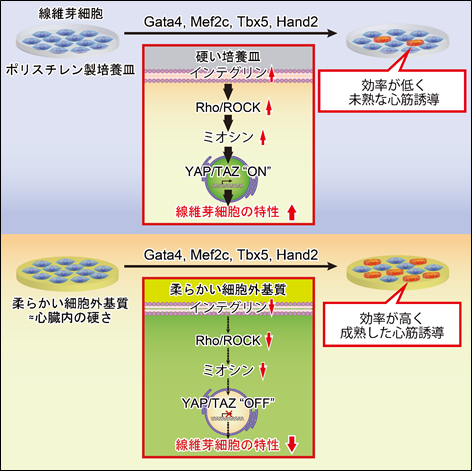
下段:生体心臓と同等の柔らかい細胞外基質では、細胞内でインテグリンシグナルと線維化経路が抑制され、心筋誘導が改善する。
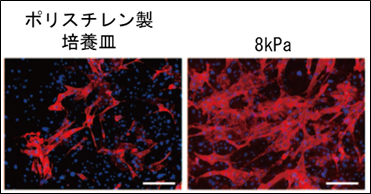
3.ベクターの種類による心筋誘導の効果
本研究では、遺伝子導入に主にレトロウイルスベクター(注10)を用いましたが、レトロウイルスベクターは宿主の遺伝子を改変する可能性があります。本研究グループは以前の研究で、宿主の遺伝子を改変せず、安全かつ効率的に心筋誘導が可能なセンダイウイルスベクターを開発してきました(文献6)。そこで、8kPaの柔らかい細胞外基質の使用により、センダイウイルスベクターによる心筋誘導が改善できるかを検討しました。その結果、柔らかい細胞外基質におけるセンダイウイルスベクターによる心筋誘導はポリスチレン培養皿の場合の約2倍に改善し、拍動する成熟した心筋細胞の誘導効率が15%まで上昇しました(図3)。以上より、柔らかい細胞外基質はウイルスベクターの種類を問わず、心筋誘導を促進することがわかりました。
今後の展開
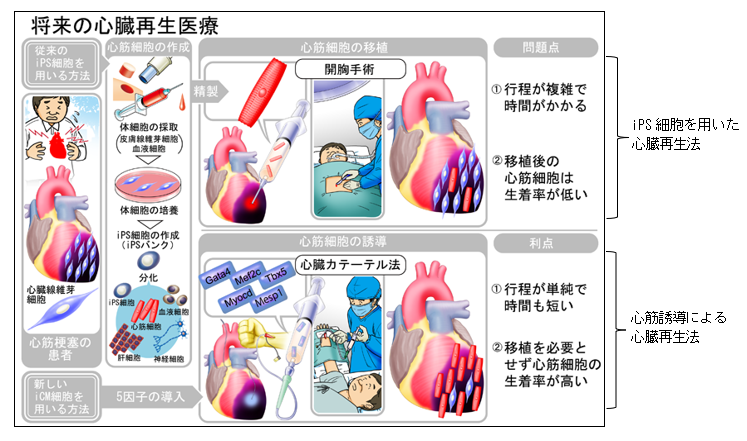
重症な心疾患に対して、心筋再生療法の確立が急務となっています。本研究では、線維芽細胞から安全・簡便・効率的に心筋細胞を誘導できる方法を開発しました。今後、心臓再生医療の実現、さらには疾患モデル作成や薬剤開発の促進が期待されます。心筋梗塞後など病的な心臓の線維化組織は、骨と同程度の硬さに変化することが知られており、本研究成果は、心臓病治療への応用に貢献すると考えられます(図4)。また、生体心臓と同等の柔らかさの細胞外基質により心筋誘導を促進するという仕組みは、他の細胞種作製でも共通する可能性があり、再生医療全体への貢献にもつながります。
用語解説
- (注1)細胞外基質
- 細胞外に存在する糖とタンパク質の複合体。細胞にとっての物理的な足場となる。
- (注2)心筋誘導遺伝子
- 本研究グループが発見したマウス心筋細胞を直接作製するために必要な3遺伝子(Gata4、Mef2c、Tbx5)あるいは4遺伝子(3遺伝子+Hand2)、ヒト心筋細胞を直接作製する5遺伝子(Gata4、Mef2c、Tbx5、Myocd、Mesp1)で、iPS細胞を樹立する時の「山中ファクター」にあたる。これら遺伝子群を線維芽細胞に導入すると、iPS細胞を経ることなく心筋細胞を直接作製できる。
- (注3)インテグリン
- 細胞表面に存在するタンパク質で、細胞外基質の受容体として細胞接着を担い、機械的刺激のシグナルを細胞内に送る。
- (注4)Rho/ROCK
- Rhoはインテグリンの下流に存在する低分子量タンパク質であり、ROCK(Rho-kinase)酵素を活性化して、アクチン・ミオシンなどの細胞骨格を制御する。
- (注5)ミオシン
- 細胞の形を決定する細胞骨格タンパクの一つで、ROCKによりリン酸化されて活性化する。
- (注6)YAP/TAZ
- 転写調節因子として核に局在(活性化)することで、細胞増殖や線維化に関連する遺伝子発現を誘導する。器官のサイズを調節するHippo経路や、インテグリンを介した機械的刺激の標的遺伝子として知られる。
- (注7)センダイウイルスベクター
- センダイウイルスベクターは、ウイルスベクターの1つで、宿主の細胞に感染したあと、宿主のゲノム(DNA)に入り込むことなく、細胞質内で遺伝子を発現しゲノムを損傷することがないという特徴をもつ。
- (注8)Pa(パスカル)
- 物質の硬さを表す単位。試料に加えた荷重をそれによってできたくぼみの面積で割った値で示す。1Paは1m2あたり1Nの力が作用する応力。
- (注9)ハイドロゲル
- 水を内部に含む物質の総称。高分子鎖が架橋された三次元網目構造の内部に多くの水分を含むゲル状の物質。本研究では細胞培養の足場(細胞外基質)として使用した。
- (注10)レトロウイルスベクター
- ベクターとは、細胞内へ遺伝子を導入する際の「運び屋」を指す。レトロウイルスベクターは、ウイルスベクターの1つで、宿主の細胞に感染したあと、宿主のゲノム(DNA)のなかに入り込み遺伝子を発現する。そのため、宿主の細胞のゲノムを損傷する可能性がある。
参考文献
- Ieda M et al. Direct Reprogramming of Fibroblasts into Functional Cardiomyocytes by Defined Factors. Cell.; 142(3): 375–386, 2010 Aug 6
- Inagawa K et al. Induction of Cardiomyocyte-like Cells in Infarct Hearts by Gene Transfer of Gata4, Mef2c, and Tbx5. Circulation Research.;111(9):1147-56, 2012 Oct 12
- Wada R et al. Induction of Human Cardiomyocyte-like Cells from Fibroblasts by Defined Factors. Pro Natl Acad Sci USA.;110(31):12667-72, 2013 Jul 30
- Muraoka N et al. MiR-133 promotes cardiac reprogramming by directly repressing Snai1 and silencing fibroblast signatures. The EMBO Journal.;33(14):1565-81, 2014 Jul 17
- Yamakawa H et al. Fibroblast Growth Factors and Vascular Endothelial Growth Factor Promote Cardiac Reprogramming under Defined Conditions. Stem Cell Reports.;5(6):1128-42, 2015 Dec
- Miyamoto K et al. Direct In Vivo Reprogramming with Sendai Virus Vectors Improves Cardiac Function after Myocardial Infarction. Cell Stem Cell.; 22(1):91-103.e5; 2018 Jan 4.
- Taketaro Sadahiro et al. Tbx6 Induces Nascent Mesoderm from Pluripotent Stem Cells and Temporally Controls Cardiac versus Somite Lineage Diversification. Cell Stem Cell.; 23(3):382-395.e5; 2018 Sep 6.
- Muraoka N et al. Role of Cyclooxygenase-2/Prostaglandin E2/Prostaglandin E Receptor 4 Signaling in Cardiac Reprogramming. Nature Communications. 10(1):674, 2019 Feb 20.
掲載論文
- 題名
- Soft Matrix Promotes Cardiac Reprogramming via Inhibition of YAP/TAZ and Suppression of Fibroblast Signatures
(柔らかな細胞外基質はYAP/TAZと線維芽細胞の特性を抑制し、心筋誘導を促進する) - 著者名
- Shota Kurotsu, Taketaro Sadahiro, Ryo Fujita, Hidenori Tani, Hiroyuki Yamakawa, Fumiya Tamura, Mari Isomi, Hidenori Kojima, Yu Yamada, Yuto Abe, Yoshiko Murakata, Tatsuya Akiyama, Naoto Muraoka, Ichiro Harada, Takeshi Suzuki, Keiichi Fukuda, Masaki Ieda
- 掲載誌
- Stem Cell Reports
- DOI
- 10.1016/j.stemcr.2020.07.022
お問合わせ先
研究内容に関すること
家田真樹(いえだまさき)
筑波大学 医学医療系(循環器内科) 教授
〒305-8572 茨城県つくば市天王台1-1-1
TEL:029-853-7515
E-mail:mieda“AT”md.tsukuba.ac.jp
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
〒100-0004 東京都千代田区大手町一丁目7番1号
(再生医療実現拠点ネットワークプログラム)
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課
TEL:03-6870-2220
E-mail:saisei“AT”amed.go.jp
(革新的先端研究開発支援事業)
シーズ開発・研究基盤事業部 革新的先端研究開発課
TEL:03-6870-2224
E-mail:kenkyuk-ask“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和2年8月28日
最終更新日 令和2年8月28日


