プレスリリース iPS細胞由来ミニ肝臓の再生医療用製造法を開発―再生医療応用における機能性・安定性の向上に貢献―
プレスリリース
横浜市立大学
東京大学医科学研究所
日本医療研究開発機構
横浜市立大学大学院医学研究科臓器再生医学谷口英樹特別契約教授(東京大学医科学研究所附属幹細胞治療研究センター再生医学分野教授)、関根圭輔客員准教授(東京大学医科学研究所附属幹細胞治療研究センター再生医学分野客員研究員、国立がん研究センター独立ユニット長)らの研究グループは、味の素株式会社、東京大学医科学研究所らと共同で、ヒトiPS細胞由来ミニ肝臓*1の製造に必要な3種類の細胞(肝臓細胞、血管内皮細胞、間葉系細胞)をヒトiPS細胞から分化誘導し、ミニ肝臓を培養するための最適な分化誘導法と生物由来原料基準*2に対応した臨床向け分化誘導用サプリメント*3(StemFit® For Differentiation[開発コードAS400])の開発に成功しました(図1参照)。
本研究で得られた成果は、ヒトiPS細胞由来ミニ肝臓の製造における安全性・安定性・機能性の向上に貢献すると期待されます。また、本研究で開発したStemFit® For Differentiationはミニ肝臓以外にもヒトiPS細胞から肝臓細胞等の内胚葉細胞の他、血管、神経等さまざまな細胞の分化誘導にも有効であることを明らかにしました。したがって、これら細胞の製造工程における臨床向け分化誘導用サプリメントとしてさまざまな再生医療の実用化に貢献すると期待されます。
※本研究は、『Scientific Reports』に掲載されます。(英国時間2020年10月21日10時付:日本時間2020年10月21日18時付オンライン)
※本研究は、国立研究開発法人日本医療研究開発機構(AMED)「再生医療実現拠点ネットワークプログラム(疾患・組織別実用化研究拠点)」の一環として行われました。
研究成果のポイント
- 未分化なiPS細胞からミニ肝臓を製造するための臨床用分化誘導法を開発
- 未分化なiPS細胞からミニ肝臓の作製に必要な肝臓細胞、血管内皮細胞、間葉系細胞を分化誘導、ミニ肝臓を培養するための、動物由来原料を含まず化学的に組成が明らかな(CD-AOF)臨床向け分化誘導用サプリメント(StemFit® For Differentiation[開発コードAS400])を開発
- 本研究で開発した分化誘導用サプリメントは肝臓細胞等の内胚葉細胞の他、血管、神経などさまざまな細胞を分化誘導にも有効であることを確認
- さまざまなヒトiPS細胞由来の再生医療用細胞の製造における品質・有効性及び安全性向上に貢献が期待される
研究の背景
再生医療に用いる細胞の製造には、安全性、安定性の観点から、ヒト以外の動物由来の物質を含まず、化学的に組成が明らかな培地の使用が生物由来原料基準(生原基)において望まれています。現在、本研究グループは2013年に確立したミニ肝臓の作製技術(Nature 499(7459): 481-4, 2013)の再生医療への応用を目指しており、安全な製品を製造するための培地が必要でした。これまでにヒトiPS細胞の分化誘導条件の検討から、高い分化誘導効率と機能性をもったミニ肝臓の作製に成功していますが、それらは研究用培地を用いた方法でした。未分化ヒトiPS細胞の培養用の生原基対応培地は京都大学の山中教授らのグループによって開発(Scientific Reports 4: 3594, 2014)されていましたが、ミニ肝臓の分化誘導用培地には生原基に対応しない成分が含まれていました。
そこで本研究では、味の素株式会社と共同で、ミニ肝臓を作製する上で必要な肝臓細胞、血管内皮細胞、間葉系細胞をそれぞれ未分化ヒトiPS細胞から分化誘導するための生原基に対応した培地、ミニ肝臓を培養するための臨床用分化誘導法の開発と生原基に対応した培地の開発に取り組みました。
研究の内容
これまでに開発したヒトiPS細胞由来ミニ肝臓に必要な全ての細胞をヒトiPS細胞から作製する分化誘導法(Cell Rep. 23(6):1620-1629, 2018)を基に、肝臓細胞の分化誘導に必要な各ステップの培地と臨床向け分化誘導用サプリメントの検討を行いました(図2)。
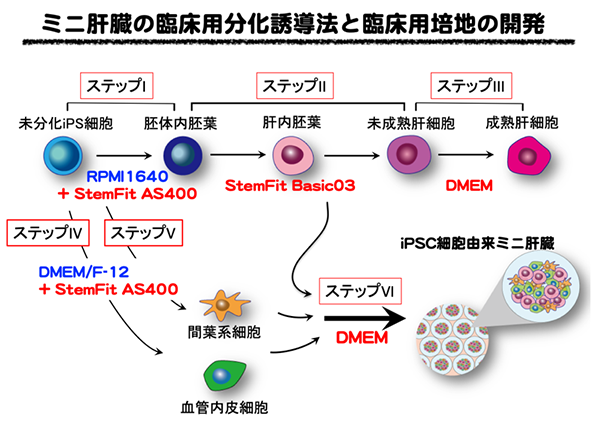
赤文字:本研究で開発・同定した培地あるいはサプリメント
まず、iPS細胞から胚体内胚葉細胞に分化誘導する図2のステップIの培地開発に成功しました。従来の分化誘導法では、ステップIでは血管内皮細胞や間葉系細胞の分化誘導においても同じサプリメントを用いていたことから、今回、肝臓細胞分化用のステップIに対して開発したサプリメントが血管内皮細胞(ステップIV)、間葉系細胞(ステップV)の分化誘導も有効かどうかを検討しました。その結果、これらの細胞の分化誘導にも有効であることが明らかとなりました。さらに、従来法でのサプリメントは神経系細胞の分化誘導にも用いられていたことから、今回開発したサプリメントについて神経系細胞の分化誘導での有効性も確認しました。次のステップIIでは、これまでに味の素株式会社において別の目的で開発されていた培地StemFit® Basic03が有効であること、さらに大幅な機能の向上に成功しました。ステップIIIでは、基礎となる培地の検討後、サプリメントの各成分を一つ一つ検討すると、ほとんどのサプリメントを除いても従来培地と同等であることを明らかにしました。ミニ肝臓培養(ステップVI)はステップIIIの培地と別の市販培地を組み合わせることで、有効な培地となることが分かりました。最終的にこれら全てを組み合わせて製造したミニ肝臓が生体内で肝機能を発揮することが示されました。
これらの結果から、未分化なiPS細胞からミニ肝臓の作製に必要な肝臓細胞、血管内皮細胞、間葉系細胞の分化誘導、ミニ肝臓を培養するための分化誘導法の開発、さらに分化誘導用サプリメントの開発に成功しました。本サプリメントは肝臓細胞等の内胚葉細胞の他、血管、神経等、さまざまな細胞の分化誘導にも有効な生原基対応分化誘導用サプリメントとして、ヒトiPS細胞由来のさまざまな再生医療用細胞の製造における品質・有効性及び安全性向上に貢献が期待されます。
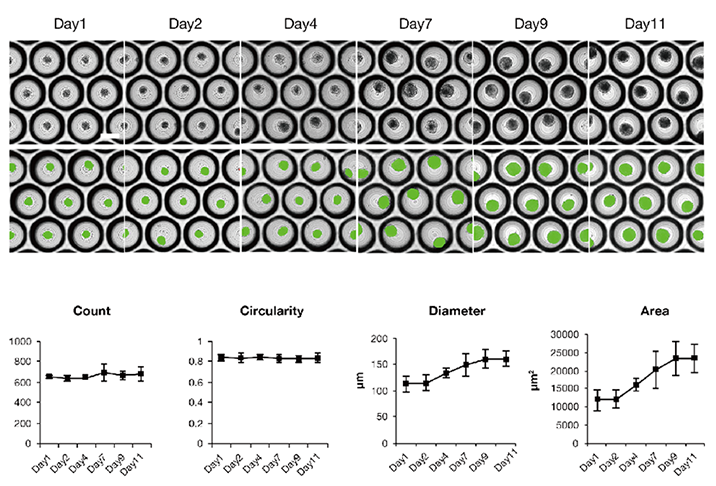
(下段)上段のミニ肝臓一つ一つを計測して数値化したもの。一定の形態のミニ肝臓が形成されていることを示している。Count:ミニ肝臓の数、Circularity:真円率(丸さ)、Diameter:直径、Area:面積
今後の展開
本研究グループでは、現在AMED「再生医療実現拠点ネットワークプログラム」において、国立成育医療研究センターとともにヒトiPS細胞由来ミニ肝臓を用いた再生医療の実現へ向け、研究開発を進めています。本研究で開発した分化誘導法および分化培地を用いることにより、品質・有効性および安全性を確保された、治験*4にも対応可能な臨床用ミニ肝臓の製造が可能となります。また、本研究を通して開発された臨床向け分化誘導用サプリメントはStemFit® For Differentiation[開発コードAS400]として味の素株式会社から販売され、ミニ肝臓だけでなく、ヒトiPS細胞を用いた他の細胞・組織・臓器の製造工程における有用性が見込まれることから、ヒトiPS細胞を用いた再生医療応用の加速への貢献が期待されます。
用語説明
- *1 ミニ肝臓
- ヒトiPS細胞から分化誘導した肝内胚葉細胞と、血管内皮細胞、間葉系細胞を最適な比率で混ぜ合わせることで、in vitro培養条件下で自律的に創出した、肝臓の基となる立体的な肝芽(ミニ肝臓)のこと(Nature 499(7459): 481-4, 2013;Nature 546(7659):533-538, 2017)。さらに、ミニ肝臓に必要な全ての細胞材料をヒトiPS細胞から分化誘導する技術、品質が一定の小型ミニ肝臓を大量製造する技術を報告している(Cell Rep. 23(6):1620-1629, 2018)。
- *2 生物由来原料基準
- 再生医療等製品を含む「医薬品等」に使用されるヒトその他の生物(植物を除く)に由来する原料又は材料について、品質・有効性および安全性を確保することを目的として、製造に使用される際に講ずべき必要な措置に関する基準(平成15年厚生労働省告示第210号、平成26年厚労省告示第375号)。
- *3 サプリメント
- 細胞培養・分化誘導には基礎培地(無機塩類、糖類、アミノ酸、ビタミンや微量元素を含む)に加え、細胞の増殖維持・分化に必要な低分子の栄養素やサイトカイン(増殖因子等)等タンパク質成分が必要です。ここでは基礎培地や分化因子(サイトカインや低分子化合物)と組み合わせて用いられる成分をサプリメントと呼んでいます。
- *4 治験
- 有効性(治療効果)や安全性(副作用)等を確認し、医薬品・再生医療等製品等として製造・販売の許可を得るために行われる臨床試験。
掲載論文
- タイトル
- Generation of human induced pluripotent stem cell-derived liver buds with chemically defined and animal origin-free media
- 著者
- Keisuke Sekine, Shimpei Ogawa, Syusaku Tsuzuki, Tatsuya Kobayashi, Kazuki Ikeda, Noriko Nakanishi, Kenta Takeuchi, Eriko Kanai, Yugo Otake, Satoshi Okamoto, Tsuyoshi Kobayashi, Takanori Takebe, Hideki Taniguchi
- 誌名
- Scientific Reports
- DOI
- 10.1038/s41598-020-73908-1
※本研究は、国立研究開発法人日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム「iPS細胞を用いた代謝性臓器の創出技術開発拠点(研究代表者:谷口英樹)」、文部科学省科学研究費補助金の一環として行われました。
お問い合わせ先
本資料の内容に関するお問い合わせ
横浜市立大学大学院医学研究科 臓器再生医学
谷口英樹、関根圭輔
TEL:045-787-8963 FAX:045-787-8963
E-mail:rtanigu“AT”yokohama-cu.ac.jp、ksekine“AT”yokohama-cu.ac.jp
取材対応窓口、詳細の資料請求等
横浜市立大学 研究・産学連携推進課長 山﨑理絵
TEL:045-787-2510
E-mail:kenkyupr“AT”yokohama-cu.ac.jp
東京大学医科学研究所 附属幹細胞治療研究センター 再生医学分野
谷口英樹、関根圭輔
TEL:03-5449-5698 FAX:03-5449-5698
E-mail:rtanigu“AT”ims.u-tokyo.ac.jp、ksekine“AT”ims.u-tokyo.ac.jp
東京大学医科学研究所 国際学術連携室(広報)清水麻子
E-mail:koho“AT”ims.u-tokyo.ac.jp
StemFit® For Differentiationに関するお問い合わせ
味の素株式会社 アミノ酸部 バイオファーマソリューションズグループ
E-mail:stemfit“AT”ajinomoto.com
AMEDの事業に関すること
国立研究開発法人日本医療研究開発機構
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課
TEL:03-6870-2220
E-mail:saiseinw“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和2年10月21日
最終更新日 令和2年10月21日


