プレスリリース 肝がん治療選択のための新たなバイオマーカーを同定―悪性度や薬物療法治療効果予測の臨床応用に期待―
プレスリリース
大阪大学
日本医療研究開発機構
研究成果のポイント
- 肝がんにおいて、悪性度の高いがんを同定できる有用なマーカーがなく、さらに、肝がんは患者ごとにその形質が異なる(腫瘍間不均一性※1)が、薬剤選択の指標となるバイオマーカーが見つかっていなかった。
- 肝がんにおけるがん遺伝子の腫瘍間不均一性が生体内で再現されたマウスモデルを開発し、FGF19※2遺伝子の発現が肝がんに対する分子標的治療薬のひとつであるレンバチニブの感受性に関連することを発見した。
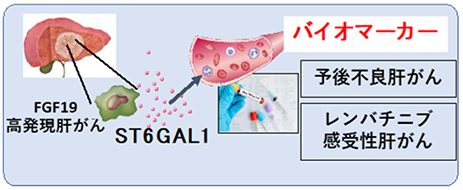
- FGF19遺伝子により制御されるST6GAL1※3の血清濃度が、高悪性度肝がんの同定や、進行肝がん患者における最良な薬物療法の選択に用いられるバイオマーカーとして臨床応用されることが期待される。
概要
大阪大学大学院医学系研究科の明神悠太医員、小玉尚宏助教、竹原徹郎教授(消化器内科学)らの研究グループは、肝がんでは患者ごとに異なる様々ながん遺伝子の異常が発症に関与している(腫瘍間不均一性)ことから、これらがん遺伝子の違いががんの悪性度や薬物療法の治療効果に影響を与えていると仮説を立て、新たなマウスモデルを樹立することで、新規バイオマーカーST6GAL1の同定に成功しました。
慢性肝疾患の患者さんは病気の進行に伴い肝がんを併発することが知られており、その発症は生命予後に大きな影響を与えます。特に悪性度の高い肝がんは早期発見が極めて重要ですが、現在用いられている腫瘍マーカーの感度は十分ではなく、悪性度の高い肝がんを同定出来る有用なバイオマーカーはありませんでした。また、これまで進行肝がんに対しては2種類の分子標的治療薬(ソラフェニブ・レンバチニブ)が標準治療に用いられてきましたが、治療効果は同程度であり薬剤選択の指標となる有用なバイオマーカーはありませんでした。
今回研究グループは、がん遺伝子の腫瘍間不均一性が生体内で再現されたマウススクリーニングモデルを開発し、FGF19高発現肝がんが分子標的治療薬レンバチニブに高感受性となることを発見しました。また、FGF19遺伝子により制御されるST6GAL1の血清濃度が予後不良なFGF19高発現肝がんの検出並びにレンバチニブ高感受性肝がんの同定に有用であることを同定しました(図1)。本研究により、血清中のST6GAL1濃度が悪性度の高い肝がんの同定や肝がん薬物療法における最適な薬剤選択のバイオマーカーとして用いられることが期待されます。
本研究成果は、米国科学誌「Clinical Cancer Research」に、2020年12月8日(火)午前0時(日本時間)に公開されます。
研究の背景
C型肝炎、B型肝炎、並びに近年増加傾向にある非アルコール性脂肪肝炎(NASH)などの慢性肝疾患の患者さんは病気の進行に伴い肝がんを併発することが知られており、その発症は生命予後に大きな影響を与えます。肝がんは、現在本邦においてがんによる死亡原因のうち第5位となっている極めて予後不良な疾患です。特に悪性度の高い肝がんは早期発見が極めて重要ですが、現在用いられている腫瘍マーカーの感度は十分ではなく、悪性度の高い肝がんを同定出来る有用なバイオマーカーはありませんでした。また、進行肝がんに対してはこれまでマルチチロシンキナーゼ阻害薬(TKI)※4であるソラフェニブとレンバチニブが標準治療として使用されてきました。現在異なる作用機序を有する新たな治療薬も開発されていますが、この2剤のTKIは肝がん治療において重要な役割を担っています。一方で、2剤の治療効果は同程度であり薬剤選択の指標となる有用なバイオマーカーはありませんでした。
がんは遺伝子の変異による病気であるという考え方に基づき、近年多数例の肝がんを対象としたがんゲノムシークエンス解析※5が世界的なプロジェクトとして行われてきました。その結果、肝がんにおいては病態進展に関わるがん遺伝子の異常が非常に多様で、患者さんごとに異なることから、極めてがん遺伝子の腫瘍間不均一性が高いことが明らかとなりました。一方で、この腫瘍間不均一性が薬物療法の治療効果に与える影響はよくわかっていませんでした。
本研究の成果
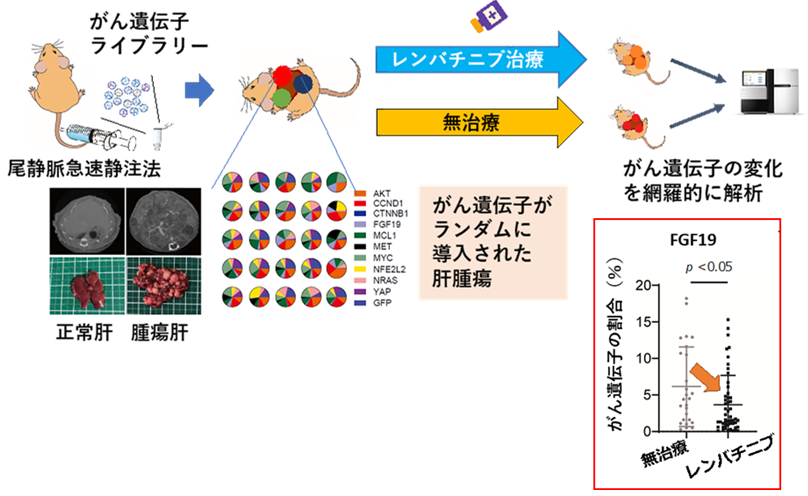
本研究グループは、がん遺伝子の違いによる腫瘍間不均一性が、がんの悪性度や薬物療法の治療効果に影響を与えていると仮説を立て研究を開始しました。まず複数のがん遺伝子を一度に肝細胞に導入する手法を確立し、これによりがん遺伝子がランダムに活性化した腫瘍間不均一性の高い肝がんを発症する新規のマウスモデルを作成することに成功しました。そこで、このモデルに対してレンバチニブ治療を行うとFGF19遺伝子を発現した腫瘍の割合が無治療群と比べて有意に減少し、FGF19高発現肝がんがレンバチニブに対して高感受性であることを見出しました(図2)。次に肝がん細胞株を用いたプロテオーム解析※6により、FGF19の発現制御を受ける分泌タンパクST6GAL1を同定しました(図3(a))。また肝がん外科切除例の検討から、血清ST6GAL1により予後不良なFGF19高発現肝がんを選別できることを見出しました(図3(b))。さらに、血清ST6GAL1濃度に基づいて患者を層別化すると、ST6GAL1高値群ではレンバチニブ治療群の予後がソラフェニブ治療群より有意に延長していることを見出しました(図3(c))。以上より、血清ST6GAL1濃度が高悪性度肝がんの同定や肝がん薬物療法における最適な薬剤選択のバイオマーカーとして有用である可能性を明らかにしました。
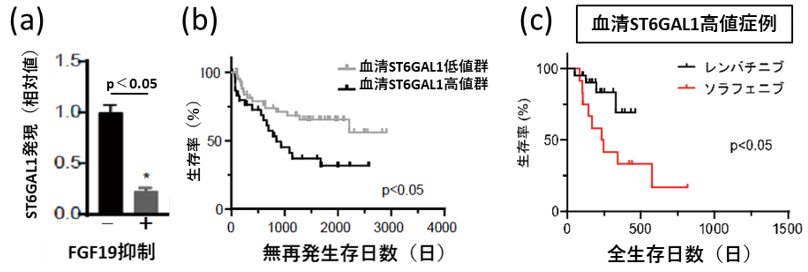
(a)肝がん細胞株において、FGF19の発現を抑制すると、ST6GAL1の発現も低下
(b)肝がん外科切除例の検討から、血清ST6GAL1高値群は低値群と比較して無再発生存日数が短い
(c)血清ST6GAL1高値群における分子標的治療症例では、レンバチニブ治療群のほうが予後が延長する(レンバチニブは2018年3月本邦承認のため観察期間が短い)
本研究成果が社会に与える影響(本研究成果の意義)
本研究により同定されたバイオマーカーST6GAL1の臨床応用が進むことで、慢性肝疾患患者における高悪性度肝がんの発見や、進行肝がん患者における薬物療法のより最適・最良な薬剤選択が可能となり、生命予後の改善に寄与することが期待されます。
特記事項
本研究成果は、2020年12月8日(火)午前0時(日本時間)に米国科学誌「Clinical Cancer Research」(オンライン)に掲載されます。
- タイトル
- “ST6GAL1 is a novel serum biomarker for lenvatinib-susceptible FGF19-driven hepatocellular carcinoma”
- 著者名
- Yuta Myojin1#, Takahiro Kodama1#, Kazuki Maesaka1, Daisuke Motooka2, Yu Sato1, Satoshi Tanaka3, Yuichi Abe4, Kazuyoshi Ohkawa5, Eiji Mita3, Yoshito Hayashi1, Hayato Hikita1, Ryotaro Sakamori1, Tomohide Tatsumi1, Ayumu Taguchi4,6, Hidetoshi Eguchi7, and Tetsuo Takehara1*(#共同筆頭著者、*責任著者)
- 所属
-
- 大阪大学 大学院医学系研究科 消化器内科学
- 大阪大学 微生物学研究所 遺伝情報実験センター ゲノム解析室
- 大阪医療センター 消化器内科
- 愛知がんセンター 分子診断トランスレーショナルリサーチ分野
- 大阪国際がんセンター 肝胆膵内科
- 名古屋大学 大学院医学系研究科 がん先端診断・治療開発学
- 大阪大学 大学院医学系研究科 消化器外科学
なお、本研究は、日本医療研究開発機構(AMED)次世代がん医療創生研究事業「がん不均一性を個体レベルでモデル化したハイスループットスクリーニング系による肝癌分子標的薬効果予測バイオマーカーの探索と耐性化機構の解明」、AMED肝炎等克服実用化研究事業肝炎等克服緊急対策研究事業「NASH及び非B非C型肝癌の病態解明と治療標的探索」、日本学術振興会(JSPS)科学研究費補助金研究の一環として行われました。
用語説明
- ※1 腫瘍間不均一性
- 同一系統の腫瘍において、個々の腫瘍毎(患者毎)にその形質(遺伝学的・病理学的・生物学的)が異なること。
- ※2 FGF19(エフジーエフナインティーン)
- 線維芽細胞成長因子19。FGF受容体に結合し胆汁酸合成を調節するホルモンとして知られる。近年肝がん進展との関連が報告されている。
- ※3 ST6GAL1(エスティ―シックスギャルワン)
- 糖転移酵素の一つで、糖鎖の末端にシアル酸を転移する酵素。
- ※4 マルチチロシンキナーゼ阻害薬(TKI)
- がん細胞が増殖する際のシグナル伝達に必要な複数のチロシンキナーゼ(酵素)を同時に阻害し、抗腫瘍作用を発揮する薬剤。現在肝細胞がんに対してはソラフェニブ、レンバチニブ、レゴラフェニブが使用されている。
- ※5 がんゲノムシークエンス解析
- 生検や手術などで採取されたがんの組織を用いて、「次世代シークエンサー」という解析装置で高速に大量のゲノムの塩基配列を読み取る技術。
- ※6 プロテオーム解析
- タンパク質を分離精製し、質量分析装置を用いてアミノ酸配列を分析し、タンパク質を同定する技術。
本件に関するお問い合わせ先
研究に関すること
小玉尚宏(こだまたかひろ)
大阪大学 大学院医学系研究科 消化器内科学 助教
TEL:06-6879-3621 FAX:06-6879-3629
E-mail:t-kodama“AT”gh.med.osaka-u.ac.jp
報道に関すること
大阪大学大学院医学系研究科 広報室
TEL:06-6879-3388 FAX:06-6879-3399
E-mail:medpr“AT”office.med.osaka-u.ac.jp
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課
TEL:03-6870-2311
E-mail:cancer“AT”amed.go.jp
疾患基礎研究事業部 疾患基礎研究課
TEL:03-6870-2225
E-mail:hepatitis“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和2年12月8日
最終更新日 令和2年12月8日


