iPS細胞から結膜上皮の作製法を確立―眼疾患への創薬・再生医療研究を加速させる新技術―
プレスリリース
大阪大学
日本医療研究開発機構
研究成果のポイント
- ヒトiPS細胞から眼オルガノイド技術を利用して結膜上皮系列細胞への分化誘導法を確立した。作製したヒトiPS細胞由来結膜上皮はムチン分泌を担う結膜杯細胞を保持する機能的上皮組織であった。
- 結膜上皮前駆細胞への分化には上皮成長因子(EGF)が、一方で前駆細胞から結膜上皮への成熟分化にはケラチノサイト成長因子(KGF)が重要であることを見出した。
- これまでの研究でヒトiPS細胞から角膜上皮の作製には成功していたが、同じく重要な眼表面の上皮である結膜上皮については作製が困難であった。
- 入手が困難であったヒト結膜上皮の基礎研究が可能となり、ドライアイなどの眼疾患に対する創薬や再生医療研究への応用が期待できる。
概要
大阪大学大学院医学系研究科の林竜平寄付講座教授(幹細胞応用医学)、西田幸二教授(眼科学、先導的学際研究機構生命医科学融合フロンティア研究部門)、能美君人特任研究員(眼科学、幹細胞応用医学)らの研究グループは日本医療研究開発機構(AMED)の支援を受け、ヒトiPS細胞からムチン分泌能を有する機能的な結膜上皮を作製する方法を新たに確立しました。
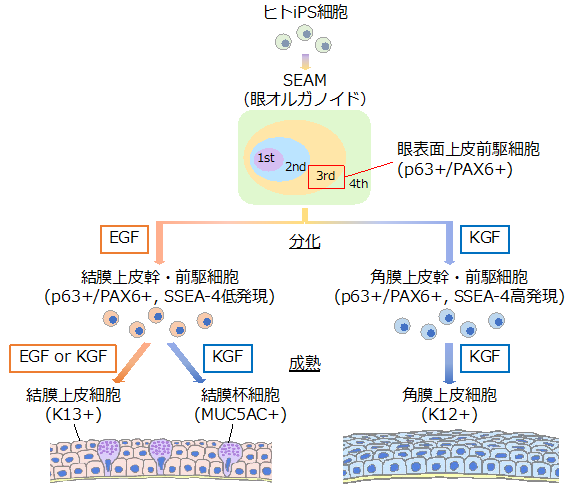
眼球の表面は角膜と結膜からなり、結膜は涙液層の維持を担っていますが、その機能が低下すると眼の表面が乾燥し、ドライアイなどの疾患になります。研究グループではこれまでにヒトiPS細胞から角膜上皮を誘導することに成功していましたが、結膜上皮の誘導方法は不明でした。今回、研究グループは、ヒトiPS細胞から誘導した二次元の眼オルガノイド用い、EGF受容体シグナルを活性化することで結膜細胞を選択的に誘導できることを見出しました。さらに、セルソーターを用いて単離したiPS細胞由来の結膜上皮前駆細胞のさらなる成熟培養を行った結果、結膜上皮および杯細胞への分化にはKGFが必要であることを明らかにしました(図1)。
本研究成果により、これまで困難であったヒト結膜細胞の大量入手が可能となり、ドライアイなどに対する創薬研究や再生医療研究において大きな進捗が期待されます。
本研究成果は、米国科学雑誌「Cell Reports」に2021年2月3日午前1時に公開されます。
研究の背景
眼の表面は主に結膜上皮と角膜上皮からなり、角膜は黒目の部分を、結膜はまぶたの裏側と眼球の表面から黒目の周囲までを覆っています。良好な視力を得るためにはこれらが相互に関連しあって機能することが必須となります。結膜上皮の重要な役割として涙液中にムチン(MUC5ACなど)を分泌することで、眼の表面を保護しています。疾患や炎症などにより結膜からのムチン分泌機能が低下すると、眼の表面が乾燥し、ドライアイとなります。しかし、結膜上皮については角膜上皮に比べ研究が進んでおらず、その理由として、ヒト結膜細胞の入手が非常に困難であること、結膜細胞の培養法が確立されていないことが挙げられます。
これまでに研究グループは、ヒトiPS細胞を用いた様々な眼の細胞を含むオルガノイドである多帯状コロニー(Self-formed Ectoderm Autonomous Multi-zone;SEAM、図2)の誘導法を確立し、SEAMを用いて角膜上皮組織の作製に成功しています。一方で、同じ眼表面上皮である結膜上皮の分化誘導法は不明でした。また、過去の報告で、EGFは結膜上皮、KGFは角膜上皮の表現系維持や増殖に関与することが示唆されていますが、これらの成長因子が発生過程に与える詳細な影響については明らかにされていませんでした。
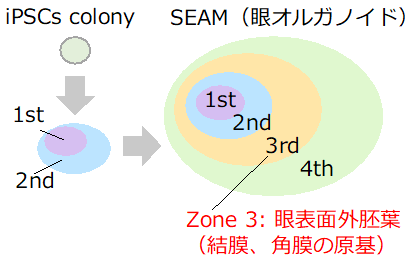
SEAMは同心円状の4層構造を形成し、zone 3に角結膜上皮原基である眼表面外胚葉が発生する。
そこで、本研究では、EGFとKGFを適切な条件下で使い分けることでSEAMからの結膜細胞の誘導、単離、成熟を目指しました。
本研究の成果
研究グループはまずヒトiPS細胞からSEAM形成後にEGFもしくはKGFを添加した際の変化を比較検討しました。EGF添加SEAM(+EGF)とKGF添加SEAM(+KGF)では、分化誘導開始6週時点において、両者ともSEAMのzone 3にp63+/PAX6+の眼表面上皮原基(角結膜上皮の原基)が誘導されました。一方、分化誘導後10週の時点では、KGF添加時にはこれまでの報告通り角膜上皮が誘導されましたが、EGFを添加した場合では、角膜上皮細胞への分化が強く抑制されることがわかりました(図3A–B)。これらの結果からEGFの添加により、SEAM中の角膜上皮分化が抑制され、結膜上皮細胞が誘導されることが示唆されました。

- EGF添加SEAM(+EGF)とKGF添加SEAM(+KGF)の免疫染色。EGF添加SEAMでは分化誘導開始から10週時点で角膜上皮細胞マーカーであるK12の発現が抑制されていた。
- EGF添加SEAMとKGF添加SEAMの遺伝子発現解析。免疫染色結果と同様にEGF添加SEAMでは角膜上皮細胞マーカー(K12、K3)発現が有意に低下していた(p<0.01)。
続いて、EGF添加SEAMを、眼表面上皮細胞の単離・解析で使用する3種類の細胞表面マーカー(CD200、SSEA-4、ITGB4)で染色後、蛍光活性化セルソーティング(FACS)で6つの画分に分離し詳細に解析しました(図4A)。その結果、CD200陰性/SSEA-4弱陽性/ITGB4陽性の画分(P2)の細胞は単離した直後では、結膜分化マーカーの発現は認められませんでしたが、重層化培養することで結膜杯細胞を含む成熟した結膜上皮に分化することが明らかとなりました。興味深いことに、この成熟培養の際には、EGFではなくKGFを添加した条件で、結膜杯細胞マーカーMUC5ACの発現上昇が認められました(図4B–C)。さらに、本研究で作製したヒトiPS細胞由来結膜上皮シートはMUC5AC分泌能も確認され(図4D)、結膜マーカーの免疫染色やムチン染色でも正常な結膜上皮と同じ特徴が確認されました(図4E–F)。
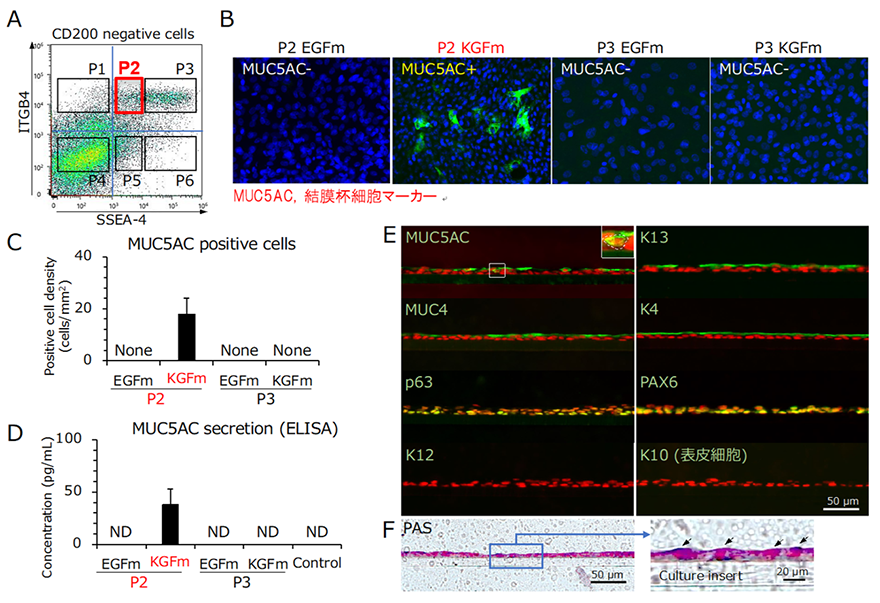
- EGFを添加し培養したSEAM(10~12週間)のFACS解析および各細胞集団の単離。
- P2およびP3画分由来上皮細胞を培養後のMUC5A免疫染色。
- 各培養条件におけるMUC5AC陽性細胞数。
- ELISAによる培養液中のMUC5AC濃度測定。Control, 培地のみ;ND, not detected。
- ヒトiPS細胞由来結膜上皮組織の免疫染色。
- PAS染色(ムチンの染色)。
また、EGFだけでなく他のEGF受容体リガンドであるTGF-αやAmphiregulinでも同様に結膜上皮前駆細胞を分化誘導出来ることが分かりました。
上記のように、本研究ではEGFなどによるEGF受容体を介したシグナルがヒトiPS細胞から結膜上皮系細胞(結膜上皮細胞、杯細胞、前駆細胞)の分化に重要であることを示し、SEAM法と組み合わせて結膜上皮細胞を誘導することに成功しました。さらに、KGFを用いることで、これまで困難であった杯細胞を有した機能的な結膜上皮の培養に成功しました。本研究により眼表面上皮細胞から結膜上皮前駆細胞への分化にはEGFなどのEGF受容体リガンド、結膜上皮前駆細胞から結膜上皮への成熟にはKGFが重要であることが示唆されました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、これまで入手が困難であったヒト結膜細胞をiPS細胞から分化誘導し、結膜や角膜を含む、眼表面上皮の機能解析や発生過程を解明するための研究ツールとして利用することが可能となりました。さらには、結膜細胞をターゲットとしたドライアイなどの眼疾患に対する創薬研究への利用や、眼表面の再生治療法開発のための研究ツールとして提供できることも期待されます。
特記事項
本研究成果は、2021年2月3日(水)午前1時(日本時間)〔2021年2月2日(火)午前11時(米国東部時間)〕に米国科学雑誌「Cell Reports」(オンライン)に掲載されます。
- タイトル
- “Generation of functional conjunctival epithelium, including goblet cells, from human iPSCs”
- 著者名
- Kimihito Nomi1,2, Ryuhei Hayashi1,2, Yuki Ishikawa1,2, Yuki Kobayashi1,2, Tomohiko Katayama1,2, Andrew J. Quantock3, and Kohji Nishida1,4
- 所属
-
- 大阪大学 大学院医学系研究科 眼科学
- 大阪大学 大学院医学系研究科 幹細胞応用医学
- カーディフ大学Structural Biophysics Group, School of Optometry and Vision Sciences, College of Biomedical and Life Sciences
- 大阪大学先導的学際研究機構 生命医科学フロンティア研究部門
なお、本研究は日本医療機構(再生医療実現拠点ネットワークプログラム技術開発個別課題「協調的眼細胞誘導法による眼腺組織作製と再生治療法開発」(研究開発代表者:林竜平)、革新的先端研究開発支援事業(AMED-CREST)「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」研究開発領域における研究開発課題「幹細胞システムに基づく4次元眼組織リモデリング機構とその破綻による疾患発症機序の解明」(研究開発代表者:西田幸二))の助成を受けて行われました。
本件に関する問い合わせ先
研究に関すること
林竜平(はやしりゅうへい)
大阪大学 大学院医学系研究科 幹細胞応用医学 寄付講座教授
TEL:06-6879-3453
E-mail:ryuhei.hayashi“AT”ophthal.med.osaka-u.ac.jp
報道に関すること
大阪大学大学院医学系研究科 広報室
TEL:06-6879-3388 FAX:06-6879-3399
Email:medpr“AT”office.med.osaka-u.ac.jp
事業に関すること
日本医療研究開発機構
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課
TEL:03-6870-2220
E-mail:saisei“AT”amed.go.jp
シーズ開発・研究基盤事業部 革新的先端研究開発課
TEL:03-6870-2224
E-mail:kenkyuk-ask“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和3年2月3日
最終更新日 令和3年2月3日


